题目内容
(1)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2H2(g)?W(s)+2H2O(g);△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O(g);△H=-137.9kJ?mol-1
则WO2(s)?WO2(g) 的△H=
(2)已知25℃、101kPa时:①2Na(s)+
O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
则25℃、101kPa 时,Na2O2(s)+2Na(s)═2Na2O(s)△H=
(3)已知甲烷、乙炔(C2H2)的燃烧热分别为-890.31kJ?mol-1、-1299.6kJ?mol-1,相同条件下两者等质量完全燃烧,甲烷放出的热量是乙炔的
WO2(s)+2H2(g)?W(s)+2H2O(g);△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O(g);△H=-137.9kJ?mol-1
则WO2(s)?WO2(g) 的△H=
+203.9 kJ?mol-1
+203.9 kJ?mol-1
.(2)已知25℃、101kPa时:①2Na(s)+
| 1 | 2 |
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
则25℃、101kPa 时,Na2O2(s)+2Na(s)═2Na2O(s)△H=
-317 kJ?mol-1
-317 kJ?mol-1
.(3)已知甲烷、乙炔(C2H2)的燃烧热分别为-890.31kJ?mol-1、-1299.6kJ?mol-1,相同条件下两者等质量完全燃烧,甲烷放出的热量是乙炔的
1.1
1.1
倍(保留一位小数).分析:(1)依据盖斯定律和热化学方程式计算得到所需热化学方程式;
(2)依据盖斯定律和热化学方程式计算分析得到需要的热化学方程式;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据摩尔质量计算等质量物质的物质的量结合燃烧热分析计算;
(2)依据盖斯定律和热化学方程式计算分析得到需要的热化学方程式;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据摩尔质量计算等质量物质的物质的量结合燃烧热分析计算;
解答:解:(1)①WO2(s)+2H2(g)?W(s)+2H2O(g);△H=+66.0kJ?mol-1
②WO2(g)+2H2(g)?W(s)+2H2O(g);△H=-137.9kJ?mol-1
依据盖斯定律①-②得到WO2(s)?WO2(g)的△H=+203.9kJ/mol;
故答案为:+203.9 kJ?mol-1;
(2):①2Na(s)+
O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
依据盖斯定律①×2-②得到:Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ?mol-1;
则25℃、101kPa 时,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ?mol-1;
故答案为:-317 kJ?mol-1;
(3)已知甲烷、乙炔(C2H2)的燃烧热分别为-890.31kJ?mol-1、-1299.6kJ?mol-1;
甲烷燃烧的热化学方程式,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ?mol-1;
乙炔燃烧的热化学方程式,C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ?mol-1;
相同条件下两者等质量完全燃烧放热量之比=
×890.31kJ?mol-1:
×1299.6kJ?mol-1≈1.1;
故答案为:1.1;
②WO2(g)+2H2(g)?W(s)+2H2O(g);△H=-137.9kJ?mol-1
依据盖斯定律①-②得到WO2(s)?WO2(g)的△H=+203.9kJ/mol;
故答案为:+203.9 kJ?mol-1;
(2):①2Na(s)+
| 1 |
| 2 |
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
依据盖斯定律①×2-②得到:Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ?mol-1;
则25℃、101kPa 时,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ?mol-1;
故答案为:-317 kJ?mol-1;
(3)已知甲烷、乙炔(C2H2)的燃烧热分别为-890.31kJ?mol-1、-1299.6kJ?mol-1;
甲烷燃烧的热化学方程式,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ?mol-1;
乙炔燃烧的热化学方程式,C2H2(g)+
| 5 |
| 2 |
相同条件下两者等质量完全燃烧放热量之比=
| 1 |
| 16 |
| 1 |
| 26 |
故答案为:1.1;
点评:本题考查了热化学方程式和盖斯定律的计算应用,热化学方程式的计算分析,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
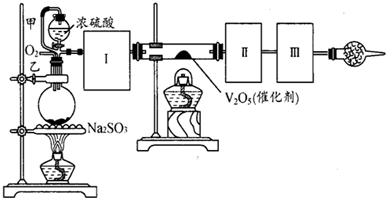
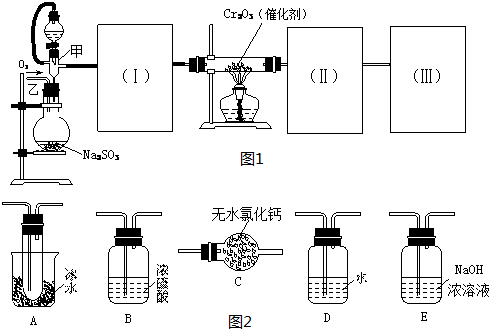
用如图装置进行SO2转化为SO3的转化率测定实验: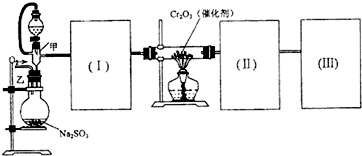
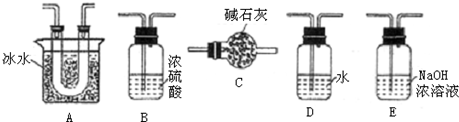
2SO2+O2
2SO3;△H=-196kJ/mol.已知:
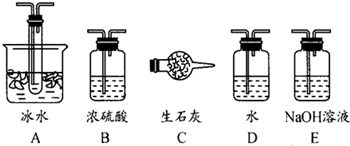
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内.Ⅰ 、Ⅱ 、Ⅲ
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) .
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是 .解释实验室要用75%的浓硫酸而不用稀硫酸制备SO2的原因
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 .
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 %(保留小数点后一位).


2SO2+O2
| Cl2O2 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为