题目内容
18.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
分析 A.依据n=$\frac{m}{M}$计算得出氧气的物质的量,然后判断O原子个数;
B.氢氧根是带有1个负电荷的阴离子,据此判断即可;
C.水在标准状况下是液体;
D.只有物质的量浓度,没有溶液的体积,无法计算其物质的量.
解答 解:A.16g氧气的物质的量n$\frac{m}{M}=\frac{16g}{32g/mol}$=0.5mol,含有氧气的分子数为0.5NA,故A错误;
B.1molOH-中含有的电子数的物质的量为8+1+1=10mol,即韩红与电子数为10NA,故B正确;
C.标准状况下,水是液体,不能利用气体摩尔体积计算其物质的量,故C错误;
D.n=c×V,不知道溶液的体积,无法计算其物质的量,故D错误,故选B.
点评 本题主要考查的是有关物质的量的计算、气体摩尔体积的应用、物质微粒个数的计算等,难度不大,属于常考题.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
13.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:根据上述实验,以下说法正确的是( )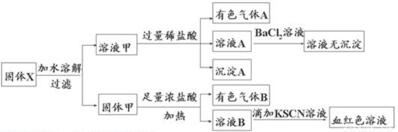

| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 无法判断溶液中是否有K2SO3 | ||
| C. | 气体A和气体B-定为混合物 | D. | 原混合物中一定有Fe2O3 |
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |