题目内容
5.用VSEPR 理论判断并完成下列填空:| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的空间构形 |
| SO3 | 0 | sp2杂化 | 平面三角形 |
| PO43- | 0 | sp3杂化 | 正四面体 |
| NCl3 | 1 | sp3杂化 | 三角锥形 |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型以及立体结构.
解答 解:SO3中价层电子对个数=3+$\frac{1}{2}$(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;
PO43-中价层电子对个数=4+$\frac{1}{2}$(5-5)=4,含孤电子对数为0,杂化轨道数4,所以原子杂化方式是sp3杂化,离子形状为正四面体;
NCl3中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,含孤电子对数为1,杂化轨道数4,所以原子杂化方式是sp3杂化,分子形状为三角锥形;
故答案为:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的空间构形 |
| SO3 | 0 | sp2杂化 | 平面三角形 |
| PO43- | 0 | sp3杂化 | 正四面体 |
| NCl3 | 1 | sp3杂化 | 三角锥形 |
点评 本题考查了原子杂化方式的判断和微粒的空间构型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错,题目难度中等.

练习册系列答案
相关题目
16.丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中正确的是( )
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
13.下列物质属于可溶性的是( )
| A. | Fe(OH)3 | B. | Cu(OH)2 | C. | Al(OH)3 | D. | Ba(OH)2 |
20.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
10.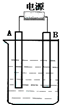 在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
 在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )| A. | 一开始A接的是电源的负极 | |
| B. | 反接电源后B电极发生氧化反应 | |
| C. | 反接电源后电解时A电极发生反应的电极反应式4OH--4e-=2H2O+O2↑ | |
| D. | 反接电源后,电解池变成了电镀池,实现了碳(B电极)上镀铜. |
17.已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质.下表中所列四种物质都易与水反应.
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式
(2)写出这四种物质与水反应的产物中,分子构型为正四面体的结构式
(3)由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl,分子结构类似于NH3,H2NCl分子的空间构型为三角锥型,电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$.
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式
| Li3N | NaNH2 | SiBr4 | Mg2Si |

(3)由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl,分子结构类似于NH3,H2NCl分子的空间构型为三角锥型,电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$.
14.下列属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
15.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | ||
| C. | 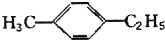 | D. | 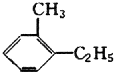 |
 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: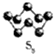 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.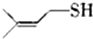 ).
).