题目内容
11.在2A(s)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )| A. | v(A)=1.8 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
分析 化学反应速率之比等于化学计量数之比,则化学反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:化学反应速率与化学计量数的比值越大,反应速率越快,则
A.A为固体,不能表示化学反应速率,
B.$\frac{0.3}{1}$=0.3,
C.$\frac{0.6}{3}$=0.2,
D.$\frac{1.6}{4}$=0.4,
显然D中比值最大,反应速率最快,
故选D.
点评 本题考查反应速率的比较,为高频考点,把握化学反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意比值法的应用,题目难度不大.

练习册系列答案
相关题目
1.现有四种有机物①C3H7Cl②C3H8O③C3H6O④C3H6O2,下列有关说法正确的是( )
| A. | ①、②、③、④均只有两种结构 | |
| B. | ①的同分异构体数目与④的相同 | |
| C. | ③一定是丙醛 | |
| D. | 若②与④能发生酯化反应,则生成的酯最多有2种 |
2.短周期主族元素X、Y、Z、W的原子序数依次增大.X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型不相同 |
19.常温下,下列关于电解质溶液的说法正确的是( )
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol•L-1的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)═c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)═c(SO42-)+c(OH-) |
6.下列说法不正确的是( )
| A. | 除去蛋白质中的葡萄糖,可以用浓硫酸铵溶液盐析过滤方法提纯 | |
| B. | 双氧水中滴加氯化铁溶液立即产生气泡,说明氯化铁的氧化性比过氧化氢强 | |
| C. | 锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+xLi═LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-═V2O5+xLi+ | |
| D. | 常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
16.下列各组元素,按原子半径依次减小,元素第一电离能逐渐增大的顺序排列的是( )
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
20.在化学试卷的开始处有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32等.请问对这些数值准确的说法应该是( )
| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |

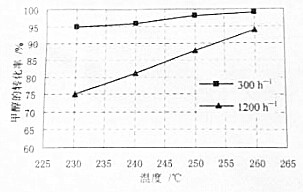 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.