题目内容
8.已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在2L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:下列说法正确的是( )| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | a=1.64 | |
| B. | 此时刻正反应速率大于逆反应速率 | |
| C. | 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
分析 A、将某时刻测得各组分的浓度折算成反应物,根据方程中式可知,当生成物溶液为0时,甲醇的浓度为1.64mol/L,而容器的体积为2L,据此判断;
B、根据Qc与K的大小判断反应进行的方向,进而确定正逆反应速率的大小;
C、该反应为气体体积不变的反应,起始时加入2a mol CH3OH与起始时加入a mol CH3OH,所得到的平衡为等效平衡,据此判断;
D、该反应的气体总质量不变,总物质的量也不变,所以在反应过程中合气体的平均摩尔质量始终不变,据此判断;
解答 解:A、将某时刻测得各组分的浓度折算成反应物,根据方程中式可知,当生成物溶液为0时,甲醇的浓度为1.64mol/L,而容器的体积为2L,所以a=1.64×2mol=3.28mol,故A错误;
B、该时刻Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,所以反向正反应方向进行,即正反应速率大于逆反应速率,故B正确;
C、该反应为气体体积不变的反应,起始时加入2a mol CH3OH与起始时加入a mol CH3OH,所得到的平衡为等效平衡,CH3OH的转化率相等,故C错误;
D、该反应的气体总质量不变,总物质的量也不变,所以在反应过程中合气体的平均摩尔质量始终不变,所以混合气体的平均摩尔质量不再变化,不能说明反应已达到平衡状态,故D错误;
故选B.
点评 本题考查化学平衡常数的有关计算与影响因素、化学平衡移动、等效平衡等,难度中等,根据化学平衡常数进行计算、判断反应进行方向是考查的趋势.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
19.下列物质属于电解质且能导电的是( )
| A. | 金属铜 | B. | 碳酸钠晶体 | C. | 硝酸钠溶液 | D. | 熔融氯化钠 |
16.下列物质中,既能与盐酸又能与氢氧化钠溶液反应,且有气体生成的是( )
| A. | Si | B. | SiO2 | C. | Al | D. | Al2O3 |
3. 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
13.下列说法中,不正确的是( )
| A. | 酚能与碳酸氢钠溶液反应 | B. | 醛能发生银镜反应 | ||
| C. | 多肽既能与酸又能与碱反应 | D. | 烯烃能与酸性高锰酸钾溶液反应 |
17.下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中体现维生素C的还原性(填“氧化性”或“还原性”).
(4)缺铁性贫血患者应补充Fe2+.一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是防止Fe2+被氧化.
| 北京市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中体现维生素C的还原性(填“氧化性”或“还原性”).
(4)缺铁性贫血患者应补充Fe2+.一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是防止Fe2+被氧化.
18.分子式为C4H8O3的有机物具有如下性质:
①浓硫酸存在时,能与CH3CH2OH、CH3COOH反应
②浓硫酸存在时,能脱水生成一种使溴水褪色的物质,该物质只存在一种结构
③浓硫酸存在时,能生成一种分子式为C4H6O2的五元环状化合物
则C4H8O3的结构简式为( )
①浓硫酸存在时,能与CH3CH2OH、CH3COOH反应
②浓硫酸存在时,能脱水生成一种使溴水褪色的物质,该物质只存在一种结构
③浓硫酸存在时,能生成一种分子式为C4H6O2的五元环状化合物
则C4H8O3的结构简式为( )
| A. | HOCH2COOCH2CH3 | B. | HOCH2CH2CH2COOH | C. | CH3CH(OH)CH2COOH | D. | CH3CH2CH(OH)COOH |

 中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式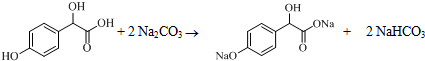 .
.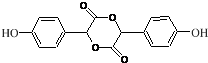 .
.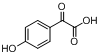 ,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.
,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.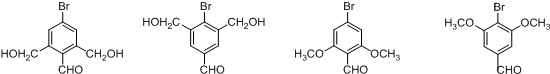 (不考虑立体异构).
(不考虑立体异构).


 .
. .
. .
. .
. .
.