题目内容
15.现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100mL2mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现.若取等质量的该混合物,用足量的CO还原可得铁单质的质量为( )| A. | 11.2 g | B. | 5.6g | C. | 8.4g | D. | 2.8g |
分析 所得溶液中加入KSCN溶液无血红色出现,则Fe、FeO、Fe2O3和Fe3O4组成的混合物与盐酸反应生成FeCl2,结合Fe原子守恒计算.
解答 解:Fe、FeO、Fe2O3和Fe3O4组成的混合物,加入100mL2mol/L的盐酸,混合物恰好完全溶解,所得溶液中加入KSCN溶液无血红色出现,混合物与盐酸反应生成FeCl2,若取等质量的该混合物,用足量的CO还原可得铁单质,由原子守恒可知Fe的物质的量等于的物质的量FeCl2,则存在2HCl~FeCl2~Fe,可知Fe的物质的量为0.1L×2mol/L×$\frac{1}{2}$=0.1mol,即取等质量的该混合物,用足量的CO还原可得铁单质的质量为0.1mol×56g/mol=5.6g,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,侧重于学生的分析与计算能力的考查,把握发生的反应、存在的关系式、原子守恒为解答该题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
(1)E的最外层电子排布式为3s23p4.
(2)D在周期表中的位置为第三周期第ⅢA族.
(3)B和C的简单离子的半径大小为O2->Na+(用离子符号和“>”“=”或“<”表示).
(4)元素非金属性的强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ad(填序号).
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中既含离子键又含共价键的化合物为Na2O2(填化学式).
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
(2)D在周期表中的位置为第三周期第ⅢA族.
(3)B和C的简单离子的半径大小为O2->Na+(用离子符号和“>”“=”或“<”表示).
(4)元素非金属性的强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ad(填序号).
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中既含离子键又含共价键的化合物为Na2O2(填化学式).
3.金属阳离子M2+的原子核外电子排布与氖原子相同,则M元素在元素周期表中的位置是( )
| A. | 第二周期第ⅡA族 | B. | 第三周期第ⅢA 族 | C. | 第三周期第ⅡA 族 | D. | 第二周期第ⅥA族 |
10.有关氨气的性质的叙述错误的是( )
| A. | 氨气能使湿润的蓝色石蕊试纸变红 | B. | 氨气极易溶于水,水溶液呈碱性 | ||
| C. | 氨和盐酸相遇能产生白烟 | D. | 氨水不稳定,受热易分解 |
7.下列物质不存在顺反异构的是( )
| A. | CH3CH=CHCH3 | B. | CHCl=CHCl | C. | CH3CH=C(CH3)2 | D. | CH3CH2CH=CHBr |
4.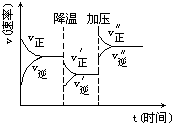 图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | A、B、C、D均为气体 | B. | 若A、B是气体,则C、D是液体或固体 | ||
| C. | 逆反应是放热反应 | D. | 在整个过程中,A的转化率一直增大 |
5.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:B>A,离子半径C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且干燥的单质D有漂白性 |
