题目内容
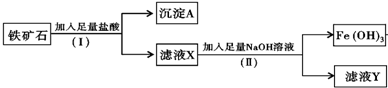
3.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.据此回答下列问题:(1)A和D的氢化物中,沸点较高的是H2O(写出化学式).
(2)写出A单质的结构式O=O.B的最高价氧化物的水化物的电子式
 .
.(3)写出E离子的离子结构示意图
 .元素D在元素周期表中的位置是第三周期VIIA族.
.元素D在元素周期表中的位置是第三周期VIIA族.(4)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为次氯酸钙.它的水溶液与D的氢化物的水溶液反应可生成D的单质,该离子方程式为ClO-+2H++Cl-=Cl2↑+H2O.
分析 地壳中含量最高的元素是O元素,故A为O,D的氢化物和最高价氧化物对应的水化物均为强酸,应为Cl元素,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,则C为Al元素,B为Na元素,E的原子数序最大,且位于20号元素之内,E和其他元素既不在同一周期也不在同一主族,应为Ca元素,根据对应原子结构特点以及对应单质、化合物的性质解答该题即可.
解答 解:依据分析可知:A为O、B为Na、C为Al、D为Cl、E为Ca,
(1)由于H2O分子间存在氢键,其沸点高于HCl,
故答案为:H2O;
(2)氧气单质中两个O原子形成2对共价键,故结构式为O=O,Na的最高价氧化物的水化物为氢氧化钠,氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,
,
故答案为:O=O; ;
;
(3)E为Ca,有4个电子层,最外层电子数为2,失去最外层2个电子形成阳离子,离子结构示意图为: ,Cl的原子核外有3个电子层,最外层电子数为7,则位于第三周期VIIA族,
,Cl的原子核外有3个电子层,最外层电子数为7,则位于第三周期VIIA族,
故答案为: ;第三周期VIIA族;
;第三周期VIIA族;
(4)钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙),由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O,离子反应为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O.
点评 本题考查元素的推断,题目难度中等,以此为载体,考查了结构式、电子式的书写,离子化合物的形成过程,离子结构示意图、离子反应方程式书写等,综合性较强,注意整理.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
13.有关热化学方程式书写与对应表述均正确的是( )
| A. | 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为110.5 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 |
14.下列溶液中的Cl-的物质的量与50mL1mol•L-1 AlCl3溶液中Cl-的物质的量相等的是( )
| A. | 150mL1mol•L-1 氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL3mol•L-1 氯化钾溶液 | D. | 75mL 1mol•L-1 氯化铁溶液 |
15.下列四种试剂均需密封保存,密封保存的原因,其中一种与其它三种不同. 这种试剂是( )
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓氨水 | D. | 苯 |
13.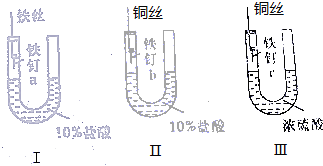 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
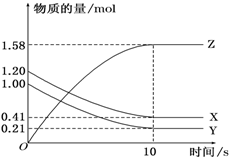 一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题: