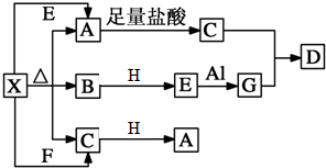
题目内容
13.蒸发时使用蒸发皿应注意的事项:①使用蒸发皿时需不需要垫石棉网?不需要;
②用酒精灯的外焰加热;
③玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅;
④加热到有大量固体析出时停止加热.
分析 ①可直接加热的仪器有:试管、燃烧匙、蒸发皿、坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;
②酒精灯的外焰温度最高;
③搅拌使液体受热均匀;
④有大量固体析出时停止加热.
解答 解:①蒸发皿可直接加热,故答案为:不需要;
②酒精灯的外焰温度最高,用外焰加热,故答案为:外;
③蒸发时也要使用玻璃棒,作用是搅拌使液体受热均匀、防止液体溅出,故答案为:搅拌,防止局部温度过高造成液滴飞溅;
④蒸发到有大量固体析出时停止加热,故答案为:有大量固体析出时.
点评 本题考查蒸发的实验操作,了解常见仪器的名称、用途、注意事项等是解答本题的关键,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
4.2A(g)+B(g)?3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
| A. | v(A)=0.7mol•L-1•min | B. | v (B)=0.3mol•L-1•min | ||
| C. | v (C)=0.9mmin | D. | v (D)=1.1mol•L-1 |
1.在一定条件下,将1mol的CO和水蒸气通入容器中发生下述反应:CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,又达到平衡后,CO2的物质的量为( )
| A. | 等于0.6 mol | B. | 等于1 mol | ||
| C. | 大于0.6 mol,小于1 mol | D. | 大于1 mol |
8.已知298K时反应2SO2( g )+O2( g )?2SO3( g );△H=-197kJ•mol-1,在相同温度下向一密闭容器中加入2molSO2和1molO2,达化学平衡时放出热量为a1 kJ;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( )
| A. | a2<a1<197 | B. | 2a2>a1>197 | C. | 2a2=a1>197 | D. | 2a2=a1=197 |
18.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如下操作:
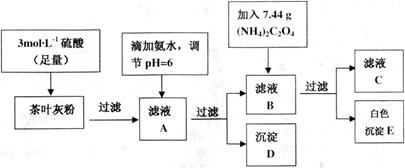
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,需用到的仪器有①③④⑤.
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;
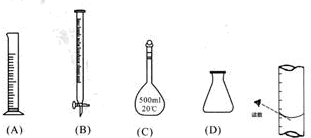
②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;

②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.
5.工业上合成氨的反应:N2(g)+3H2(g)═2NH3(g)△H=-92.60kJ•mol-1.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
3.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 1mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |