题目内容
1.分别含有下列离子的溶液:Cu2+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+:(1)呈黄色的是Fe3+.
(2)滴加过量NaOH溶液中,一直无沉淀的是Ba2+.
(3)加过量NaOH溶液并振荡后,仍有白色沉淀的是Mg2+.
(4)滴加过量NaOH溶液过程中,白色沉淀生成后又溶解的是Al3+.
(5)Fe2+中滴加过量NaOH溶液的现象是Fe2+.
(6)加入KSCN溶液无变化,再滴入少量氯水后溶液变红色的是Fe2+.
分析 (1)溶液中呈黄色的离子为铁离子;
(2)钡离子和氢氧化钠不反应不能生成沉淀;
(3)加过量NaOH溶液并振荡后,仍有白色沉淀的是镁离子;
(4)滴加过量NaOH溶液过程中,白色沉淀生成后又溶解的是铝离子;
(5)Fe2+中滴加过量NaOH溶液的现象是生成白色沉淀迅速变化为灰绿色,最后变化为红褐色;
(6)加入KSCN溶液变红色证明含铁离子,亚铁离子无此现象.
解答 解:(1)溶液中呈黄色的离子为铁离子,浅绿色为亚铁离子,铜离子溶液中显蓝色,Mg2+、Al3+离子在溶液中无色,
故答案为:Fe3+;
(2)Cu2+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+中钡离子和氢氧化钠不反应不能生成沉淀,故答案为:Ba2+;
(3)加过量NaOH溶液并振荡后,Cu2+生成蓝色沉淀氢氧化铜,Mg2+生成白色沉淀氢氧化镁,Al3+生成氢氧化铝沉淀又溶于氢氧化钠溶液无沉淀生成,Ba2+不反应,Fe2+生成不是沉淀氢氧化亚铁沉淀,Fe3+中生成红褐色沉淀,溶液中仍有白色沉淀的是镁离子,
故答案为:Mg2+;
(4)氢氧化铝是两性氢氧化物,溶于氢氧化钠溶液,滴加过量NaOH溶液过程中,白色沉淀生成后又溶解的是铝离子,故答案为:Al3+;
(5)氢氧化亚铁易被空气中 的氧气氧化生成氢氧化铁沉淀,所以Fe2+中滴加过量NaOH溶液的现象是生成白色沉淀迅速变化为灰绿色,最后变化为红褐色,
故答案为:Fe2+;
(6)加入KSCN溶液无变化,说明无铁离子,再滴入少量氯水后溶液变红色的是亚铁离子,故答案为:Fe2+.
点评 本题考查了离子性质、离子检验、离子在溶液中颜色、离子反应及其现象等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
13.A、B、C为短周期元素,请根据如表信息回答问题.
①第一电离能:A<B(填“>”、“<”或“=”),基态C原子的电子排布式为1s22s22p63s23p1.
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为原子晶体.
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为原子晶体.
10.下列除杂方法正确的是( )
| A. | 用硫酸铜溶液除去铁粉中混有的铜粉 | |
| B. | 用碳酸钙除去氯化钙溶液中混有的稀盐酸 | |
| C. | 用稀硫酸除去氯化钠中混有的碳酸钠 | |
| D. | 用点燃方法除去二氧化碳中混有的一氧化碳 |
11.下列反应的离子方程式书写正确的是( )
| A. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯化镁溶液与过量氨水反应:Mg2++2NH3•H2O═Mg (OH)2↓+2NH4+ |
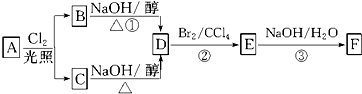
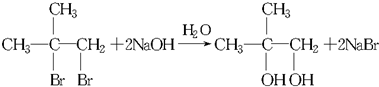 .
.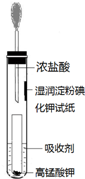 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4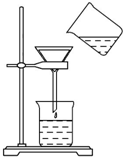 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题: