题目内容
3.下列说法正确的是( )| A. | 分子式为C4H10OH的醇,其结构可能有5种 | |
| B. | 乙烷与氯气在光照条件下反应的有机物共有6种 | |
| C. | 苯既能使溴的四氯化碳溶液褪色,又能在铁催化下与夜溴发生取代反应 | |
| D. | 相同质量的甲烷和乙烷完全燃烧甲烷耗氧量多 |
分析 A、先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目;
B、根据乙烷分子中含有的氢原子个数判断;
C、苯能萃取溴使溴的四氯化碳溶液褪色,在铁催化下与液溴发生取代反应;
D、根据甲烷和乙烷的燃烧方程式判断.
解答 解:A、戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-CH(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则戊醇的可能结构有8种,故A错误.
B、乙烷分子中含有6个氢原子,所以乙烷发生取代反应生成的有机物中一氯乙烷(1种)、二氯乙烷(2种)、三氯乙烷(2种)、四氯乙烷(2种)、五氯乙烷(1种)、六氯乙烷(1种),所以共有9种,故B错误.
C、苯能萃取溴使溴的四氯化碳溶液褪色,又能铁催化下与液溴发生取代反应,故C正确.
D、甲烷和乙烷的燃烧方程式分别为:假设分别燃烧1mol燃料,需要的氧气分别为
CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O
1mol 2mol
1mol 2mol
2C2H6+7O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+6H2O
2mol 7mol
1mol 3.5mol
所以燃烧相同物质的量的甲烷和乙烷,乙烷需要的氧气多,故D错误.
故选C.
点评 本题主要考查有机物的性质,题目比较容易,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
7.如图表示4个单体构成的化合物,下列叙述错误的是( )


| A. | 若单体是4种氨基酸.则该化合物为四肽.其彻底水解后的产物再重新组合成四肽,共有24种排列方式 | |
| B. | 若单体是葡萄糖,则该化合物不能与斐林试剂发生特定的颜色反应 | |
| C. | 若单体是4种脱氧核苷酸,则该化合物彻底水解的产物是4个脱氧核糖、4个磷酸和4种碱基(A、O、G、C) | |
| D. | 若单体是4种核苷酸,则初步水解该化合物需要3个水分子. |
11.有5瓶白色固体试剂,分别是Ba(NO3)2、KCl、NaOH、CuSO4、和Na2SO4,现只提供蒸馏水,通过下面的实验步骤可鉴别它们.请填写下列空白.
(1)各取少量固体试剂加入5支试管中,加入适量蒸馏水,振荡试管,观察到的现象是溶液呈蓝色.被检出的物质的化学式是CuSO4
(2)分别向剩下的4种溶液的试管中加入(1)中已检出的溶液,观察到的现象和相应的化学反应方程式是:
(3)最后可利用Ba(NO3)2的试剂(填化学式)鉴别余下未检出的物质.
(1)各取少量固体试剂加入5支试管中,加入适量蒸馏水,振荡试管,观察到的现象是溶液呈蓝色.被检出的物质的化学式是CuSO4
(2)分别向剩下的4种溶液的试管中加入(1)中已检出的溶液,观察到的现象和相应的化学反应方程式是:
| 现象 | 化学反应方程式 | |
| ① | 试管中有白色沉淀生成 | Ba(NO3)2+CuSO4═BaSO4↓+Cu(NO3)2 |
| ② | 试管中有蓝色沉淀生成 | CuSO4+2NaOH═Cu(OH2)↓+2NaNO3 |
18.铁钉和碳棒用导线连接后,浸入0.01mol\l的食盐溶液中,可发生的反应是( )
| A. | 碳棒上放出氯气 | B. | 铁钉上放出氢气 | C. | 碳棒上放出氧气 | D. | 铁钉锈蚀 |
8.在主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 原子序数:Z<Y<X<W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:HXO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |
15.检验久置的FeSO4是否变质,最好选用的试剂是( )
| A. | 铁片 | B. | NaOH溶液 | C. | 石蕊溶液 | D. | KSCN溶液 |
12.实验室用下图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).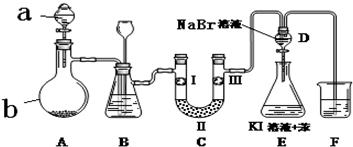
(1)a、b两仪器的名称:a分液漏斗;b蒸馏烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯的非金属性大于溴(填“大于”或“小于”).
(6)F处为烧碱溶液,写出吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.

(1)a、b两仪器的名称:a分液漏斗;b蒸馏烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)F处为烧碱溶液,写出吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
13.下列变化中一定为放热反应的是( )


| A. | 用CO在高温条件下还原CuO的反应 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+182.6 kJ•mol-1 | |
| C. | 形成化学键过程中放出862kJ热量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |