题目内容
10.金属钠是银白 色的金属,很容易与空气中的氧气、水 等反应,因此实验室通常把金属钠放在煤油 中保存.钠与滴有酚酞的水反应时可观察到的实验现象有abcd(填字母).
a.钠浮在水面上 b.钠熔成小球 c.钠四处游动 d.溶液变为红色.
分析 依据钠为银白色金属,密度小于水大于煤油,熔点低的物理性质,结合钠性质活泼极易与空气中水、氧气反应特点选择钠的保存方法;
钠与水反应生成氢氧化钠和氢气,结合钠的物理性质解答.
解答 解:钠为银白色金属,密度小于水大于煤油,熔点低的物理性质,结合钠性质活泼极易与空气中水、氧气反应,所以通常将钠放在煤油中保存,可以隔绝空气;
钠密度小于水,熔点低,钠与水反应生成氢氧化钠和氢气,同时放出大量的热,所以可以看到:.浮在水面上,钠熔成小球;
钠与水反应生成的氢气推动钠四处游动,生成氢氧化钠为碱性物质,溶液呈碱性所以遇到酚酞变红;
所以看到现象为:abcd;
故答案为:银白;氧气、水;煤油;abcd;
点评 本题考查了元素化合物知识,熟悉钠的物理性质和化学性质即可解答,题目难度不大,注意积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.检验Fe3+,最好的方法是加入( )
| A. | 氯水 | B. | KSCN溶液 | C. | 石蕊溶液 | D. | 酚酞溶液 |
15.下列电池不属于化学电池的是( )
| A. | 一次电池 | B. | 二次电池 | C. | 燃料电池 | D. | 太阳能电池 |
3.根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )
(ⅰ) I2(?)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ) I2(?)+H2(g)?2HI(g)△H=26.48kJ/mol.
(ⅰ) I2(?)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ) I2(?)+H2(g)?2HI(g)△H=26.48kJ/mol.
| A. | ⅰ中碘为气态,ⅱ中碘为固态 | |
| B. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 | |
| C. | 1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ | |
| D. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |

 形成六元环酯的结构简式
形成六元环酯的结构简式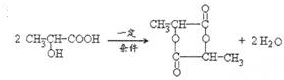 .
.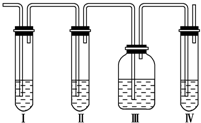 实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.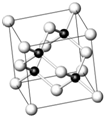 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题: