题目内容
2.下列有关说法正确的是( )| A. | 实验室制氢气,为了加快反应速率,可将稀硫酸改成浓硫酸 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气转化率增大 | |
| D. | 反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)的△H>0 |
分析 A、注意利用浓硫酸具有强氧化性来解答;
B、依据沉淀转化的依据分析判断;
C、升高温度,化学平衡向着吸热方向进行;
D、该反应的△S<0,常温下能自发进行,必须△H<0.
解答 解:A、因浓硫酸具有强氧化性,则铁与浓硫酸反应生成二氧化硫,而得不到氢气,故A错误;
B、硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,故B正确;
C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应逆向进行,氢气转化率减小,故C错误;
D、该反应的△S<0,常温下能自发进行,必须△H<0,故D错误;
故选B.
点评 本题目是一道综合考查题,考查学生化学反应速率的影响因素、化学平衡移动原理的应用、沉淀转化以及反应的方向等方面知识,难度中等.

练习册系列答案
相关题目
12.原子序数依次增大的短周期元素A、B、C、D,其中A 元素的一种核素形成的单质是核聚变的理想材料,B 元素原子最外层电子数是电子层数的3 倍;C 元素原子为它所在周期中原子半径最大的主族元素;D 元素是地壳中含量最丰富的金属元素.下列叙述正确的是( )
| A. | B、C、D 形成的简单离子半径依次增大 | |
| B. | B、C 形成的化合物只含有离子键 | |
| C. | A、C、D 形成的化合物CDA4,属于离子化合物,有较强的还原性 | |
| D. | A、B、C 形成的化合物与B、C、D 形成的化合物可以发生化学反应 |
13.下列说法不正确的是( )
| A. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| B. | 正戊烷的沸点高于丙烷 | |
| C. | 1 mol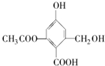 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol | |
| D. | 分子式为C4H8O2的有机物能与NaOH溶液反应的有6种 |
10.在298K、1.01×105 Pa下,将22gCO2通入750mL 1mol•L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1molCO2通入1L2mol•L-1 NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
17.《天工开物》第七卷《陶埏(陶瓷)》中“水火既济而土合.…后世方土效灵,人工表异,陶成雅器,有素肌、玉骨之象焉”所述的“陶成雅器”的主要原料是( )
| A. | 黏土 | B. | 纯碱、石灰石、石英砂 | ||
| C. | 黏土、石灰石 | D. | 二氧化硅、硅酸钙、硅酸铝 |
7.下列有关物质的性质或应用的说法不正确的是( )
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl- | |
| B. | 0.1 mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO4 2-、Cl- | |
| C. | 0.1 mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| D. | c(H+):c(OH-)=1012mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
11.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| B. | NaCl$\stackrel{通电}{→}$Na$\stackrel{TiCl_{4}溶液}{→}$ Ti | |
| C. | MgCl2•6H2O $\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
9.温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气)?pC(气),达到平衡后,若将混合气体的体积压缩到原来的$\frac{1}{2}$,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中正确的是( )
| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |