题目内容
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO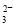 )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A.①④ B.②⑤ C.①③ D.②④
B
【解析】
试题分析:①NaHCO3溶液加水稀释,促进HCO3-的水解,n(HCO3-)较小,n(Na+)不变,则c(Na+)/ c(HCO3-)的比值保持增大,故正确;②浓度均为0.1mol?L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,根据物料守恒可知c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,故错误;③在0.1mol?L-1氨水中滴加0.1mol?L-1盐酸,刚好完全中和时pH=a,则溶液中由水电离出产生酸雾c(OH-)=c(H+)=10-amol?L-1,故正确;④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,抑制亚硫酸钠的水解,所以c(Na+)、c(SO32-?)均增大,故④正确;⑤在Na2S稀溶液中根据质子守恒可知c(H+)=c(OH?)?+?c(H2S)+c(HS-?),故⑤错误,答案选B。
考点:考查水的电离、溶液中离子浓度大小比较、盐类水解等

(10分)C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
离子半径 | 酸性 | 还原性 | 得电子能力 |
N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
 C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,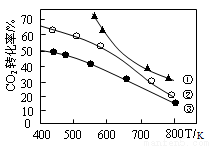
 NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I) (ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。

