题目内容
(10分)C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
离子半径 | 酸性 | 还原性 | 得电子能力 |
N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(1)二周期 IVA族 14C (2)> < < =
(3)O=C=O  (4)O>N>C, C D
(4)O>N>C, C D
【解析】
试题分析:(1)C元素位于元素周期表中的第二周期 IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C;
(2)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则氮离子半径大于铝离子半径;氯元素的非金属性强于硫元素,则高氯酸的酸性强于硫酸;硫元素的非金属性弱于氧元素,则硫离子的还原性强于氧离子的还原性;互为同位素原子的化学性质相同,则得电子能力相等;
(3)溶于水和在熔融状态下均不能自身电离出离子的化合物是非电解质,则CO2是非电解质,结构式为O=C=O;硫化钾是离子化合物,熔点最高,电子式为 ;
;
(4)同周期自左向右非金属性逐渐增强,则非金属性强弱顺序是O>N>C;判断非金属性强弱可以利用最高价氧化物对于水化物的酸性强弱或其单质与氢气化合的难易程度,故答案为CD。
考点:考查元素周期表的结构以及元素周期律的应用

 阅读快车系列答案
阅读快车系列答案下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端管口放出 |
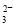 )+c(HCO
)+c(HCO )]
)]



 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、