题目内容
写出下列反应的离子方程式,指了氧化剂和还原剂,并计算.Fe+CuSO4═FeSO4+Cu离子方程式 ;氧化剂 ;还原剂 ;当生成128g铜时,转移的电子 mol.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:反应中Fe元素化合价升高,被氧化,Cu元素化合价降低,被还原,结合化合价的变化解答该题.
解答:
解:反应的离子方程式为Fe+Cu2+═Fe2++Cu,反应中Fe元素化合价升高,被氧化,Fe为还原剂,Cu元素化合价降低,被还原,CuSO4为氧化剂,
n(Cu)=
=2mol,转移4mol电子,
故答案为:Fe+Cu2+═Fe2++Cu;CuSO4;Fe;4.
n(Cu)=
| 128g |
| 64g/mol |
故答案为:Fe+Cu2+═Fe2++Cu;CuSO4;Fe;4.
点评:本题考查离子方程式、氧化还原反应,为高频考点,明确离子方程式的写法及电荷守恒即可解答,并利用元素的化合价来分析氧化还原反应,难度不大.

练习册系列答案
相关题目
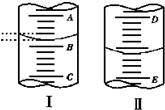 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )| A、Ⅰ中是3.2 mL,Ⅱ中是3.40 mL |
| B、Ⅰ中是4.8 mL,Ⅱ中是3.40 mL |
| C、Ⅰ中是3.2 mL,Ⅱ中是4.60 mL |
| D、Ⅰ中是4.8 mL,Ⅱ中是4.60 mL |
当溶液中有大量的H+和Ba2+时,下列离子中有可能大量存在的是( )
| A、SO42- |
| B、CO32- |
| C、Cl- |
| D、OH- |
下列各组离子在无色透明的酸性溶液中能大量共存的是( )
| A、Fe3+、HCO3-、Cl-、Na+ |
| B、SO42-、NO3-、Ba2+、Cu2+ |
| C、MnO4-、Na+、K+、Mg2+ |
| D、Ca2+、Cl-、NO3-、Na+ |
根据以下反应判断:Fe3+、Fe2+、Cu2+的氧化性强弱顺序是( )
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |