题目内容
11.配制一定物质的量浓度的溶液,下列仪器不必使用的是( )| A. | 玻璃棒 | B. | 容量瓶 | C. | 漏斗 | D. | 胶头滴管 |
分析 配制一定物质的量浓度的溶液,基本步骤为:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,据此判断需要的仪器.
解答 解:配制一定物质的量浓度的溶液,基本步骤为:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平(量筒)、烧杯、玻璃棒、胶头滴管、容量瓶等,用不到漏斗,
故选:C.
点评 本题考查了配制一定物质的量浓度溶液用到的仪器,明确配制步骤及各步操作用的仪器即可解答,题目难度不大,注意容量瓶规格选择及使用方法.

练习册系列答案
相关题目
19.将1mol氯气通入足量的氢氧化钠溶液,反应后对所得溶液的描述正确的是( )
| A. | 所得溶液中氯化钠的浓度为1 mol/L | |
| B. | 向所得的溶液中通入二氧化碳,可使溶液具备漂白性 | |
| C. | 所得溶液中有大量的单质的氯元素存在 | |
| D. | 在反应中氯元素化合价降低,钠元素化合价升高 |
6.下述实验能达到预期实验目的是( )
| A. | 室温下,通过用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,半分钟不变色 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
16. 常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )
常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )
 常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )
常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
9.下列物质中,分子的一端亲水,分子的另一端亲油的是( )
| A. | CH3(CH2)15SO3Na | B. |  | C. | CCl4 | D. | CH3(CH2)4COOCH3 |
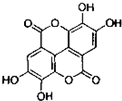 ).
).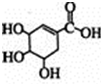 +Br2→
+Br2→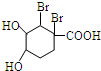 .
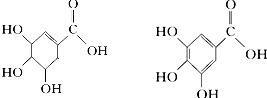
.
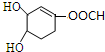 .
.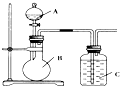 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.