题目内容
下列实验过程中,始终无明显现象的是( )
| A、Cl2通入FeSO4溶液中 |
| B、CO2通入Ca(OH)2溶液中 |
| C、将AlCl3溶液滴入 NaOH 溶液中 |
| D、SO2通入BaCl2溶液中 |
考点:氯气的化学性质,二氧化硫的化学性质,钠的重要化合物
专题:
分析:根源化学方程式判断溶液中是否有沉淀、气体、颜色变化来确定选项.
解答:
解:A、Cl2+2Fe2+=2Fe3++2Cl-,Fe2+被氧化成Fe3+,溶液颜色由浅绿色变为黄色,故A错;
B、CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=2Ca(HCO3)2,溶液先有白色沉淀后消失,故B错;
C、将AlCl3溶液滴入 NaOH 溶液中,先有白色沉淀,后沉淀溶解,故C错;
D、SO2与BaCl2溶液不反应,始终无明显现象,故D正确; 故选:D
B、CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=2Ca(HCO3)2,溶液先有白色沉淀后消失,故B错;
C、将AlCl3溶液滴入 NaOH 溶液中,先有白色沉淀,后沉淀溶解,故C错;
D、SO2与BaCl2溶液不反应,始终无明显现象,故D正确; 故选:D
点评:本题考查了氯气、二氧化硫、氯化铝、氢氧化钙的性质,属元素化合物的综合题,根据化合物的性质判断是否反应来确定选项.

练习册系列答案
相关题目
在BaCl2溶液中通入SO2气体,溶液仍澄清.将BaCl2溶液分别盛入两支试管中,一支加氨水,另一支加硝酸溶液,然后再通入SO2,结果两试管都有白色沉淀.由此得出的下列结论中合理的是( )
| A、BaCl2有两性 |
| B、两支试管的白色沉淀均是亚硫酸钡 |
| C、SO2有还原性和酸性氧化物的通性 |
| D、以上说法均不合理 |
将过量的氯气通入溴化钠溶液中,再向溶液中加入一定量的CCl4,充分振荡,观察到的现象是( )
| A、溶液有无色变橙色 |
| B、上层几乎无色,下层显橙色 |
| C、溶液由橙色变无色 |
| D、上层无色,下层为紫色 |
已知一定条件下断裂或生成某些化学键的能量关系如下表:对于反应:H2(g)+Cl2 (g)=2HCl (g),下列说法正确的是( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、该反应的反应热△H>0 |
| B、生成1mol HCl时反应放热91.5kJ |
| C、Cl2中的化学键比H2中的化学键更稳定 |
| D、相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
一般硫粉含有S(单斜)和S(正交)两种同素异形体.已知常温下:
S(单斜)+O2(g)=SO2(g)△H=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H=-296.83kJ/mol
下列说法错误的是( )
S(单斜)+O2(g)=SO2(g)△H=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H=-296.83kJ/mol
下列说法错误的是( )
| A、S(g)+O2(g)=SO2(g)△H<-297.16 kJ/mol |
B、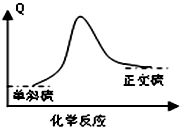 单斜硫转变为正交硫的能量变化可用图表示 |
| C、常温下正交硫比单斜硫稳定 |
| D、单斜硫转化为正交硫的反应是放热反应 |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法不正确的是( )| A、该电池工作时将化学能转化为电能 |
| B、电子从电极b经外电路流向电极a |
| C、该电池中的电极b是正极 |
| D、在电极a上发生氧化反应 |

 )是合成APM的原料之一.APM的结构简式如图1所示.
)是合成APM的原料之一.APM的结构简式如图1所示.