题目内容
16.下列生活中常见的现象中,其反应原理不涉及氧化还原的是( )| A.铁的冶炼 | B.电池放电 | C.天然气燃烧 | D.碳酸氢钠做发酵粉 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 反应中存在化合价变化的反应为氧化还原反应,铁的冶炼、原电池反应、天然气燃烧都涉及氧化还原反应,只有碳酸氢钠做发酵粉属于非氧化还原反应,据此进行解答.
解答 解:A.铁的冶炼过程中,Fe元素从化合价变为游离态,存在化合价变化,属于氧化还原反应,故A错误;
B.电池放电过程中,负极失去电子发生氧化反应,正极得到电子发生还原反应,属于氧化还原反应,故B错误;
C.天然气的燃烧属于氧化还原反应,故C错误;
D.碳酸氢钠做发酵粉,为碳酸氢钠的分解,不存在化合价变化,则不属于氧化还原反应,故D错误;
故选D.
点评 本题考查氧化还原反应的判断,题目难度不大,明确氧化还原反应的特征为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
7.复方蒿甲醚是目前国际上广泛认可的中国原创药品,它在疟疾这一高传染性疾病治疗史上具有里程碑的意义.该药品主要成分是青蒿素,结构如图.有关青蒿素的叙述中正确的是( )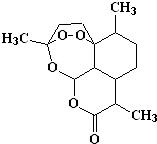

| A. | 青蒿素的化学式为C16H20O5 | |
| B. | 该有机物不能和NaOH溶液反应 | |
| C. | 青蒿素易溶于水 | |
| D. | 由于青蒿素中含有过氧键(-O-O-),具有较强的氧化性 |
4.A与B在溶液中进行反应,无论A与B的物质的量之比如何,都可以用所示的离子方程式表示的是( )
| A. | 碘化钾与氯气:5I-+3Cl2-+3H2O→IO3-+6Cl-+6H+ | |
| B. | KAl(SO4)2与Ba(OH)2:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O | |
| C. | 氨水与SO2:NH3•H2O+SO2→HSO3-+NH4+ | |
| D. | NaAlO2与AlCl3:Al3++3AlO2-+6H2O→4Al (OH)3↓ |
11.仅能在水溶液中导电的电解质是( )
| A. | KOH | B. | KCl | C. | CO2 | D. | NH4HCO3 |
1.下列属于碱性氧化物的是( )
| A. | CaO | B. | Na2O2 | C. | SiO2 | D. | Mn2O7 |
8.下列说法正确的是( )
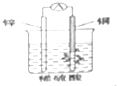

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 右图原电池中,电流由锌棒经外电路流向铜棒 | |
| C. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
5.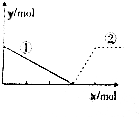 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )
 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )| A. | ①Al3+ ②Al(OH)3 | B. | ①Al3+ ②AlO${\;}_{2}^{-}$ | ||
| C. | ①Al(OH)3 ②Al3+ | D. | ①AlO${\;}_{2}^{-}$ ②Al3+ |
19.埋在地下的铸铁输油管道,在下列情况下被腐蚀得最慢的是( )
| A. | 在潮湿疏松的碱性土壤中 | B. | 在干燥致密的酸性土壤中 | ||
| C. | 将输油管道与电源负极相连 | D. | 在输油管道接口处包上铜皮 |