题目内容
6.下列图示与对应的叙述相符的是( )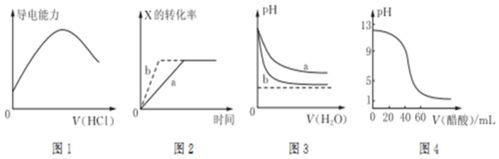
| A. | 图1表示向氨水中通入HC1气体,溶液的导电能力变化 | |
| B. | 图2所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| C. | 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 | |
| D. | 图4可表示用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液得到的滴定曲线 |
分析 A.向氨水中通入HCl气体,溶液的导电能力增强;
B.b曲线表示的反应比a反应速率快,平衡不移动;
C.一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释两种溶液时,促进一水合氨电离,利用两溶液在稀释时强碱的变化程度大来分析解答;
D,0.1mol/L氢氧化钠溶液pH=13,当醋酸的体积是40mL时,混合溶液中存在的溶质是醋酸钠,溶液显碱性.
解答 解:A.向氨水中通入HCl气体,生成氯化铵为强电解质,则溶液的导电能力增强,当氨水完全反应后,继续通HCl,溶液的导电增强,故A错误;
B.图2所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的可以是使用催化剂,故B错误;
C.一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释溶液促进弱电解质电离,导致稀释溶液氢氧化钠溶液中氢氧根离子浓度变化较大,氨水中氢氧根离子浓度变化较小,pH变化较小,则a是氨水溶液,故C正确;
D.0.100 0 mol/L NaOH溶液pH=13,用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液,消耗草酸溶液体积40ml生成醋酸钠,溶液显碱性,图象起点错误,故D错误;
故选C.
点评 本题考查图象题,根据外界条件对反应速率、化学平衡的影响来分析解答,注意分析曲线的变化趋势,题目难度中等.

练习册系列答案
相关题目
16.W、X、Y、Z是原子序数依次最大的短周期元素,W的原子半径最小,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍,下列说法中不正确的是( )
| A. | 由W和X两种元素形成的化合物可能含有非极性共价键 | |
| B. | 由X、Y、Z三种元素形成的化合物只能为Y2ZX2或Y2ZX4 | |
| C. | 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性 | |
| D. | W、X、Y、Z四种元素两两之间形成二元化合物 |
17.下列说法正确的是( )
| A. | 在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法 | |
| B. | KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等 | |
| C. | 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| D. | 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
14.清华大学王晓琳教授首创三室棋电解法制备LiOH,其工作原理如图所示,下列说法正确的是( )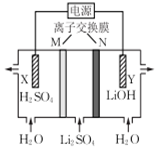

| A. | X电极连接电源负极 | |
| B. | N为阳离子交换膜 | |
| C. | Y电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 制备2.4 g LiOH产生的H2在标准状况下为2.24 L |
1.下列指定反应的离子方程式正确的是( )
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 用惰性电极电解 MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向NH4Al(SO4)2溶液中加入过量的 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向含NH3的污水中加入NaClO将其转化为N2:3ClO-+2NH3═3Cl-+N2↑+3H2O |
2. 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
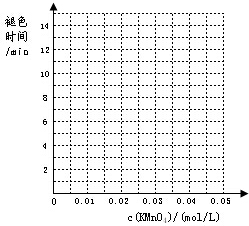
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
9.下列说法正确的是( )
| A. | 化学反应的焓变与反应的途径无关 | |
| B. | 盐酸与氢氧化钠溶液的反应中一定有化学键的断裂和形成 | |
| C. | 白酒的蒸馏、石油的分馏、煤的干馏都是化学变化 | |
| D. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 |
6.下列关于Fe(OH)3胶体的说法中不正确的是( )
| A. | Fe(OH)3胶体与硫酸溶液混合会聚沉成红褐色沉淀 | |
| B. | Fe(OH)3胶体粒子在电场影响下会发生电泳现象 | |
| C. | Fe(OH)3胶体粒子在不停地做布朗运动 | |
| D. | 光线通过Fe(OH)3胶体时会发生丁达尔现象 |
7.25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,当混合溶液的pH=10时,酸和碱的体积之比为( )
| A. | 10:1 | B. | 9:1 | C. | 1:9 | D. | 1:10 |