题目内容
15.在固定容积的容器中盛有1molPCl5,200℃时发生如下反应:PCl5(g)?PCl3+Cl2(g)达到平衡时,PCl5体积分数为M%.若恒温下向容器中再通入1molPCl5,再次达平衡时,PCl5所占体积分数为N%,则M和N的关系是( )| A. | M>N | B. | M<N | C. | M=N | D. | 无法判断 |
分析 若恒温下向容器中再通入1molPCl5,相当于开始加入2molPCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,据此进行判断.
解答 解:若恒温下向容器中再通入1molPCl5,相当于开始加入2molPCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,即平衡向逆反应方向移动,PCl5所占体积分数增大,故M<N,
故选B.
点评 本题考查了化学平衡及其影响,题目难度中等,明确影响化学平衡的因素为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍.关于元素周期表及这六种元素性质,请回答:
(1)这六种元素的氢化物中,最稳定的是H2O.(写化学式);
(2)AC2的电子式为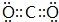 .
.
(3)在一定条件下,由B单质与H2反应生成1molG时,放出的热量为46.2kJ,写出该反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式8NH3+3Cl2═6NH4Cl+N2.该反应中被氧化的G与参与反应的G的质量之比1:4.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:2H2S+SO2=3S↓+2H2O.
| A | B | C |
| D | E | F |
(2)AC2的电子式为
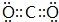 .
.(3)在一定条件下,由B单质与H2反应生成1molG时,放出的热量为46.2kJ,写出该反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式8NH3+3Cl2═6NH4Cl+N2.该反应中被氧化的G与参与反应的G的质量之比1:4.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:2H2S+SO2=3S↓+2H2O.
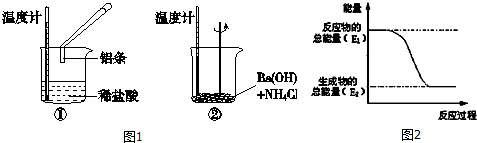
7.某同学利用如图1装置探究温度对化学平衡的影响,已知烧瓶中存在如下平衡:2NO2?N2O4△H<0.当进行图2实验后,以下结论正确的是( )
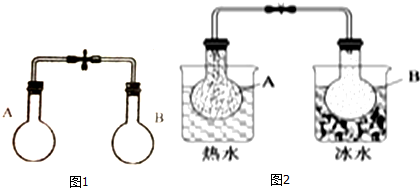

| A. | 图2中,B烧瓶颜色较深 | |
| B. | 图2中,B烧瓶与A烧瓶相比有较多的NO2 | |
| C. | 图2中B烧瓶的正反应速率比图1中B烧瓶的快 | |
| D. | 图2中A烧瓶的正反应速率比图1中A烧瓶的快 |
4.为了鉴别乙烯、甲苯、苯酚溶液、乙醇溶液四种无色的液体,可以使用下列试剂合理的一组是( )
| A. | KMnO4酸性溶液 | B. | 银氨溶液 | ||
| C. | 溴水 | D. | 新制Cu(OH)2和FeCl3溶液 |
5.下列关于同分异构体数目的叙述不正确的是( )
| A. | 分子式为C5H12的烃有3种同分异构体 | |
| B. | 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种 | |
| C. | 含有5碳原子的饱和链烃,其一氯代物只有3种 | |
| D. | 菲的结构为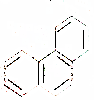 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |