题目内容
在一定条件下可实现下列物质间的转化,如图所示:

(1)固体A是一种重要的工业原料,其化学式为 .W的电子式为
(2)写出W与气体丙反应的化学方程式
(3)利用上图中有关物质实现C→B的转变,写出该转变的离子方程式:
(4)上述变化中的B和丙按物质的量3:2反应的离子方程式为: .
(5)若甲和乙恰好完全反应,则W与A的物质的量之比为 .

(1)固体A是一种重要的工业原料,其化学式为
(2)写出W与气体丙反应的化学方程式
(3)利用上图中有关物质实现C→B的转变,写出该转变的离子方程式:
(4)上述变化中的B和丙按物质的量3:2反应的离子方程式为:
(5)若甲和乙恰好完全反应,则W与A的物质的量之比为
考点:无机物的推断
专题:推断题
分析:淡黄色固体W可与水反应,应为Na2O2,则B为NaOH,甲为O2,固体A是一种重要的工业原料,可与水反应生成气体,且生成的气体可在氧气中燃烧,则A为CaC2,乙为C2H2,C为Ca(OH)2,E为H2O,丙为CO2,D为Na2CO3,结合对应物质的性质解答该题.
解答:
解:淡黄色固体W可与水反应,应为Na2O2,则B为NaOH,甲为O2,固体A是一种重要的工业原料,可与水反应生成气体,且生成的气体可在氧气中燃烧,则A为CaC2,乙为C2H2,C为Ca(OH)2,E为H2O,丙为CO2,D为Na2CO3,
(1)固体A是一种重要的工业原料,其化学式为CaC2,W为Na2O2,电子式为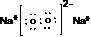 ,故答案为:CaC2;
,故答案为:CaC2;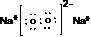 ;
;
(2)过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)C为Ca(OH)2乳浊液,可与碳酸钠反应生成碳酸钙沉淀和NaOH,反应的离子方程式为Ca(OH)2+CO32-=CaCO3↓+2OH-,
故答案为:Ca(OH)2+CO32-=CaCO3↓+2OH-;
(4)NaOH和CO2按照3:2反应的离子方程式为3OH-+2CO2=CO32-+HCO3-+H2O,故答案为:3OH-+2CO2=CO32-+HCO3-+H2O;
(5)甲和乙恰好完全反应,反应的方程式为5O2+2C2H2=4CO2+2H2O,结合2Na2O2+2CO2=2Na2CO3+O2、CaC2+2H2O=Ca(OH)2+C2H2可知,Na2O2与CaC2的物质的量之比为5:1,
故答案为:5:1.
(1)固体A是一种重要的工业原料,其化学式为CaC2,W为Na2O2,电子式为
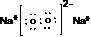 ,故答案为:CaC2;
,故答案为:CaC2;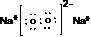 ;
;(2)过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)C为Ca(OH)2乳浊液,可与碳酸钠反应生成碳酸钙沉淀和NaOH,反应的离子方程式为Ca(OH)2+CO32-=CaCO3↓+2OH-,
故答案为:Ca(OH)2+CO32-=CaCO3↓+2OH-;
(4)NaOH和CO2按照3:2反应的离子方程式为3OH-+2CO2=CO32-+HCO3-+H2O,故答案为:3OH-+2CO2=CO32-+HCO3-+H2O;
(5)甲和乙恰好完全反应,反应的方程式为5O2+2C2H2=4CO2+2H2O,结合2Na2O2+2CO2=2Na2CO3+O2、CaC2+2H2O=Ca(OH)2+C2H2可知,Na2O2与CaC2的物质的量之比为5:1,
故答案为:5:1.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质的颜色和工业用途等重要特征,为解答的突破口,难度不大,注意相关基础知识的积累.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
分离苯和水混合物的操作方法是( )
| A、过滤 | B、分液 | C、萃取 | D、蒸馏 |
 有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).
有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应). 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:





 2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.
2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.
