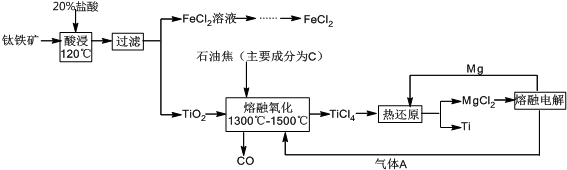
题目内容
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会
(4)影响中和热测定结果的关键因素在于:
考点:中和热的测定
专题:化学反应中的能量变化
分析:(1)根据少量盐酸在反应中挥发,反应的盐酸偏少,放出的热量偏小;
(2)先判断三次反应温度差的有效性,然后求出平均值,再根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(3)根据弱电解质电离吸收热量;
(4)在中和反应中,必须确保热量不散失;可以用保温杯代替烧杯;
(2)先判断三次反应温度差的有效性,然后求出平均值,再根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(3)根据弱电解质电离吸收热量;
(4)在中和反应中,必须确保热量不散失;可以用保温杯代替烧杯;
解答:
解:(1)少量盐酸在反应中挥发,盐酸挥发吸收热量,且盐酸偏少,放出的热量偏小,测得的中和热数值偏低;故答案为:偏低;
(2)3次反应前后温度差分别为:6.6℃、6.7℃、6.8℃,均有效,平均值为
=6.7℃,50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g?℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g?℃)×100g×6.7℃=28.006KJ,即生成0.5mol的水放出热量28.006KJ,所以生成1mol的水放出热量为28.006KJ×2=56.01kJ,即该实验测得的中和热△H=-56.01kJ/mol;
故答案为:-56.01kJ/mol;
(3)醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量偏低,测得的中和热的数值会偏低;
故答案为:偏低;醋酸为弱酸,电离过程为吸热过程;
(4)在中和反应中,必须确保热量不散失;为减小实验误差,可采取的措有用保温杯代替烧杯;
故答案为:保温;用保温杯代替烧杯;
(2)3次反应前后温度差分别为:6.6℃、6.7℃、6.8℃,均有效,平均值为
| 6.6℃+6.7℃+6.8℃ |
| 3 |
故答案为:-56.01kJ/mol;
(3)醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量偏低,测得的中和热的数值会偏低;
故答案为:偏低;醋酸为弱酸,电离过程为吸热过程;
(4)在中和反应中,必须确保热量不散失;为减小实验误差,可采取的措有用保温杯代替烧杯;
故答案为:保温;用保温杯代替烧杯;
点评:本题考查热反应热的测定与计算,题目难度大,注意理解中和热测定原理以及测定反应热的误差等问题.

练习册系列答案
相关题目
下列离子方程式中书写正确的是( )
| A、向硫酸亚铁溶液中通入H2S气体:Fe2++H2S→FeS↓+2H+ |
| B、碳酸钙溶于醋酸:CaCO3+2CH3COOH→Ca2++2CH3COO-+CO2↑+H2O |
| C、少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-→H2O+CO32- |
| D、稀氯化铵溶液和澄清石灰水混合:NH4++OH-→NH3?H2O |