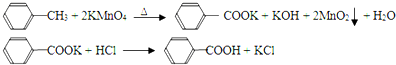
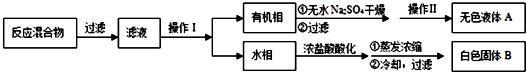
题目内容
根据下列某些短周期元素的性质回答问题:
(1)元素①、②和⑧的第一电离能由大到小的顺序是 (填元素符号);元素③、⑥和⑨的氢化物中沸点由高到低的顺序是 (填化学式).
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 、 (写两种,写化学式).
(3)元素①和⑨形成阳离子,其电子式为 .
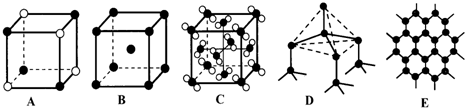
(4)元素②和⑦形成晶体的部分结构可用如图中的 来表示(填序号).
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有
(3)元素①和⑨形成阳离子,其电子式为
(4)元素②和⑦形成晶体的部分结构可用如图中的

考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:元素①、②和⑧,均处于短周期,且原子半径①<⑧<②,且最高正价为+1价,故①为氢,②为钠,⑧为锂;⑥和⑨的最高正价为+5,最低负价为-3,且原子半径⑥>⑨,故⑥为磷,⑨为氮,⑤的半径大于N,故⑤为碳,③的半径小于N,且最低负价为-2,故③为氧,⑩的半径小于O,且最低负价为-1,故⑩为氟;⑥的半径大于⑦,⑦的最低负价为-1,最高正价为+7,⑦为氯;依据前面分析可知①为氢,⑨为氮,可形成铵根;②为钠,⑦为氯,可形LiCl,据此得出①为H,②为Na,③为O,④为Al,⑤为C,⑥为P,⑦为Cl,⑧为Li,⑨为N,⑩为氟,据此解答各小题即可.
解答:
解:(1)元素①、②、⑧,均处于短周期,且原子半径依次增大,且最高正价为+1价,故①为氢,②为钠,⑧为锂,元素的非金属性越强,则第一电离能越大,由于非金属性H>Li>Na,故第一电离能的大小顺序为:H>Li>Na;⑥和⑨的最高正价为+5,最低负价为-3,且原子半径⑥>⑨,故⑥为磷,⑨为氮,③的半径小于N,且最低负价为-2,故③为氧,它们的氢化物分别为:H2O、PH3、NH3,由于水分子和氨气分子间能形成氢键,故沸点高低顺序为:H2O>NH3>PH3,故答案为:H>Li>Na;H2O>NH3>PH3;
(2)⑥的半径大于⑦,⑦的最低负价为-1,最高正价为+7,⑦为氯,③为氧,⑤的半径大于N,故⑤为碳,C、P、Cl两种元素形成的化合物中,CCl4、PCl3的每个原子都满足了最外层8个电子的稳定结构,故答案为:CCl4,PCl3;
(3)依据前面分析可知①为氢,⑨为氮,可形成铵根:NH4+,铵根的电子式为: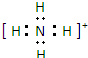 ,故答案为:
,故答案为: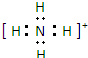 ;
;
(4)②为钠,⑦为氯,可形NaCl,NaCl晶胞中Na原子与Cl原子个数比为1:1,故答案为A.
(2)⑥的半径大于⑦,⑦的最低负价为-1,最高正价为+7,⑦为氯,③为氧,⑤的半径大于N,故⑤为碳,C、P、Cl两种元素形成的化合物中,CCl4、PCl3的每个原子都满足了最外层8个电子的稳定结构,故答案为:CCl4,PCl3;
(3)依据前面分析可知①为氢,⑨为氮,可形成铵根:NH4+,铵根的电子式为:
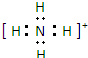 ,故答案为:
,故答案为: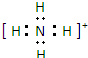 ;
;(4)②为钠,⑦为氯,可形NaCl,NaCl晶胞中Na原子与Cl原子个数比为1:1,故答案为A.
点评:本题主要考查的是元素的推断以及元素周期律的应用,熟练掌握第一电离能的概念、氢化物的稳定性比较方法以及晶胞的计算是关键.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
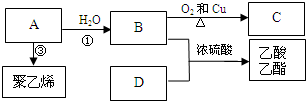
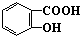 对下列物质有如图的转化关系:
对下列物质有如图的转化关系: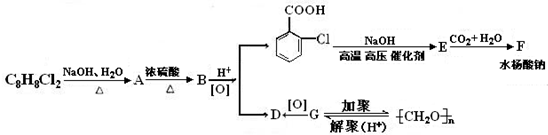
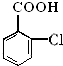 生成E的反应中所消耗NaOH的物质的量是
生成E的反应中所消耗NaOH的物质的量是