题目内容
用单线桥标出下列反应中的电子转移的方向及数目.
(1)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(2)MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
(1)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(2)MnO2+4HCl(浓)
| ||
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)Cu失去电子,N得到电子,由失去电子的元素指向得到电子的元素,并利用元素的化合价变化来确定转移的电子总数;
(2)Mn元素失去电子,Cl元素得到电子,该反应中转移2e-,以此来解答.
(2)Mn元素失去电子,Cl元素得到电子,该反应中转移2e-,以此来解答.
解答:
解:(1)Cu元素失去电子,N元素得到电子,转移的电子总数为3×2e-=6e-,单线桥标电子转移的方向和数目为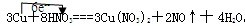 ,
,
故答案为: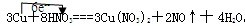 ;
;
(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,
故答案为: (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
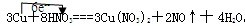 ,
,故答案为:
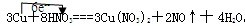 ;
;(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目
 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,故答案为:
 (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重电子转移方向和数目的考查,题目难度不大.

练习册系列答案
相关题目
下列仪器中,可用酒精灯加热的是( )
| A、集气瓶 | B、量筒 |
| C、试管 | D、分液漏斗 |
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7X+5FeSO4+12H2SO4,下列说法正确的是( )
| A、X的化学式为CuS,它既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有10 mol电子转移 |
| C、产物中的SO42-离子有一部分是氧化产物 |
| D、FeS2只作还原剂 |
人们利用纳米级(1~100nm,1nm=10-9m)粒子物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用.将纳米级粒子物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述不正确的是( )
| A、该分散系能产生丁达尔效应 |
| B、该分散质颗粒能透过滤纸 |
| C、该分散质颗粒能透过半透膜 |
| D、该分散质颗粒能发生布朗运动 |
一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1molCl2与足量的氢氧化钠溶液反应转移的电子数为0.2 NA |
| B、12.5mL 16mol/L浓硫酸与足量铜反应,转移的电子数为0.2NA |
| C、6.2g氧化钠和7.8g过氧化钠中所含有的离子数均为0.3 NA |
| D、2.24L氯气与氢氧化钠溶液完全反应转移的电子数为0.1 NA |