题目内容
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力变化如下图.
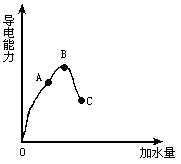
(1)图中O点时导电能力为0,原因是________.
(2)A,B,C三点对应溶液的pH由大到小的顺序是________.
(3)A,B,C三点对应溶液中,醋酸电离程度最大的是________.
(4)使C点溶液中c(CH3COO-)增大,pH也增大,可向溶液中加入的物质为________,________,________.
解析:
|
(1)只有醋酸分子,没有发生电离 (2)C>A>B;(3)C (4)NaOH固体,CH3COONa固体,活泼金属(如锌等) 导解:O点没有水,为纯醋酸.导电能力与溶液中离子浓度成正比,所以导电能力越大,氢离子浓度也越大,pH越小.水加得越多,溶液浓度越小,弱电解质电离程度越大,c点加水量最大,所以电离程度最大.要使溶液中c(CH3COO-)增大,pH也增大,即c(H+)减小,根据CH3COOH |

(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 |
| 不填 | 不填 |
| 加水 |
|
| 不填 |
| 加盐酸 | 不填 |
|
|
| 加少量氢氧化钠固体 | 不填 | 不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____10C(H+)乙(填“大于”、“小于”或 “等于”),
 CH3COO-+H+,只需反应消耗H+或加入CH3COO-离子即可.
CH3COO-+H+,只需反应消耗H+或加入CH3COO-离子即可. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )