题目内容
12.下列给出的MgCl2的电子式中,正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 氯化镁为离子化合物,氯化镁中存在镁离子和氯离子,氯离子还需要标出最外层电子,注意氯离子用中括号括起来,并标注带电数目,据此解答.
解答 解:氯化镁为离子化合物,化学式中存在镁离子和2个氯离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,
,
故选:C.
点评 本题考查了电子式的书写,明确离子化合物与共价化合物的电子式的表示方法及区别,注意掌握电子式的概念及表示方法即可解答,注意化学用语的规范性.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
2.下列有关Si、Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
3.可逆反应A(g)+3B(g)?2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A. | v(A)=9.0mol/(L•min) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.3 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
20.根据下列实验操作及现象,所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向10mL 1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 现有白色沉淀,后为红褐色沉淀 | Mg(OH)2转化为Fe(OH)3 |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32-或HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色沉淀,后者为红褐色液体 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
7.设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 7.8g N2O2晶体中阴离子数目为0.2NA | |
| B. | 含1mol NH4Cl和少量NH3•H2O的中性溶液中,NH${\;}_{4}^{+}$数目为NA | |
| C. | 电解精炼铜时,阳极质量减少64g外电路导线上通过的e-数目为NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA |
1.关于工业生产的下列叙述中,不正确的是( )
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
6. 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:
Ⅰ.(1)已知:
①C(s)+2H2(g)═CH4(g)△H1=a kJ•mol-1;
②C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H2=b kJ•mol-1;
则2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=2(b-a)kJ•mmol-1(用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O═Mg(OH)2+Mn2O3;则工作时,正极发生还原反应(填反应类型),写出负极的电极反应式:Mg+2OH--2e-=Mg(OH)2;
(3)一定温度下,在1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:
CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min 内生成CaO的质量为11.2g,则该段时间内v(CaC2O4)=0.04mol•mim-1;
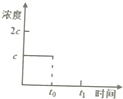
若某时刻达到平衡时c(CO2)=c;t0时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在如图中画出t0以后此体系中CO2的浓度随时间变化的图象.
Ⅱ.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).如表是某温度下几种常见弱酸的电离平衡常数:
回答下列各题:
(4)根据以上条件,请比较同浓度的CH3COOHNa、NaClO、Na2CO3、NaHCO3、Na3PO4、NaH2PO4、Na2HPO4溶液,则它们pH最大的是Na3PO4(填化学式,下同),pH最小的是NaH2PO4.
(5)向NaClO溶液中通入过量的二氧化碳,发生的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
Ⅲ.(6)取一定量主要含有I-、Cl-等离子溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为4.7×10-7.【已知Ksp(AgCl)=1.8×10-10,Ksp(Agl)=8.5×10-17】.
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:Ⅰ.(1)已知:
①C(s)+2H2(g)═CH4(g)△H1=a kJ•mol-1;
②C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H2=b kJ•mol-1;
则2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=2(b-a)kJ•mmol-1(用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O═Mg(OH)2+Mn2O3;则工作时,正极发生还原反应(填反应类型),写出负极的电极反应式:Mg+2OH--2e-=Mg(OH)2;
(3)一定温度下,在1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:
CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min 内生成CaO的质量为11.2g,则该段时间内v(CaC2O4)=0.04mol•mim-1;
若某时刻达到平衡时c(CO2)=c;t0时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在如图中画出t0以后此体系中CO2的浓度随时间变化的图象.
Ⅱ.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).如表是某温度下几种常见弱酸的电离平衡常数:
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.6×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(4)根据以上条件,请比较同浓度的CH3COOHNa、NaClO、Na2CO3、NaHCO3、Na3PO4、NaH2PO4、Na2HPO4溶液,则它们pH最大的是Na3PO4(填化学式,下同),pH最小的是NaH2PO4.
(5)向NaClO溶液中通入过量的二氧化碳,发生的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
Ⅲ.(6)取一定量主要含有I-、Cl-等离子溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为4.7×10-7.【已知Ksp(AgCl)=1.8×10-10,Ksp(Agl)=8.5×10-17】.
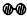 、
、 、
、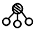 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.