题目内容
6.有一种pH为2的HCl溶液100mL,要使它的pH升到3:(1)如果加入蒸馏水,应加900 mL(不考虑溶液体积变化,下同).
(2)如果加入pH=4的HCl溶液,应加1000 mL.
分析 (1)根据稀释前后氯化氢的物质的量不变计算;
(2)根据混合溶液中c(H+)=$\frac{n(酸)_{1}+n(酸)_{2}}{{V}_{1}+{V}_{2}}$来计算;
解答 解:(1)稀释前酸中氢离子浓度为0.01mol/L、稀释后酸中氢离子浓度为0.001mol/L,
①稀释前后氯化氢的物质的量不变,所以稀释后溶液体积=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=1000mL,则加入水的体积=1000mL-100mL=900mL,故答案为:900;
(2)设加入的pH=4的HCl溶液的体积为VmL,根据混合溶液中c(H+)=$\frac{n(酸)_{1}+n(酸)_{2}}{{V}_{1}+{V}_{2}}$可知:10-3mol/L=$\frac{1{0}^{-2}mol/L×0.1L+1{0}^{-4}mol/L×VmL×1{0}^{-3}}{(100+V)×1{0}^{-3}L}$,解得V=1000mL,故答案为:1000.
点评 本题考查了PH的简单计算,根据溶液稀释、酸碱中和反应、羧酸混合特点来计算溶液的pH,注意:水的离子积常数只与温度有关,溶液的酸碱性由氢离子和氢氧根离子浓度相对大小判断,不能根据氢离子浓度大小判断,为易错点.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
14.下列化学反应的离子方程式正确的是( )
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
1.常温下,把1ml PH=6的H2SO4溶液加入蒸馏水中,制成100mL溶液,稀释后的溶液中,其C(H+)最接近( )
| A. | 1×10-8mol/L | B. | 1×10-6mol/L | C. | 2×10-8mol/L | D. | 1×10-7mol/L |
15.X元素的阳离子和Y元素的阴离子的核外电子层结构相同,下列叙述正确的是( )
| A. | 离子半径X>Y | B. | 原子半径X<Y | ||
| C. | 原子序数X<Y | D. | 原子最外层电子数X<Y |
16.下列反应中不属于可逆反应的是( )
| A. | SO2溶于水和H2SO3分解 | |
| B. | H2跟I2化合成HI和HI分解 | |
| C. | SO2跟O2化合成SO3和SO3分解 | |
| D. | 电解水生成H2与O2和H2与O2转化成H2O |
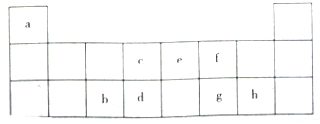 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: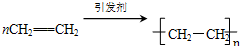 ;
;
 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ -CH3+HBr;
-CH3+HBr; .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
. +
+ .
. .
.