题目内容
1.常温下,把1ml PH=6的H2SO4溶液加入蒸馏水中,制成100mL溶液,稀释后的溶液中,其C(H+)最接近( )| A. | 1×10-8mol/L | B. | 1×10-6mol/L | C. | 2×10-8mol/L | D. | 1×10-7mol/L |
分析 根据强酸的稀释规律:将pH=a的强酸加水稀释至原体积的10b倍,溶液的pH=a+b(当a+b>7时,溶液的pH=7),据此来分析.
解答 解:硫酸是强电解质,在水溶液中完全电离,根据强酸的稀释规律:将pH=a的强酸加水稀释至原体积的10b倍,溶液的pH=a+b,但当a+b>7时,溶液总的氢离子以水电离出的为主,即此时溶液的pH=7,故C(H+)最接近1×10-7mol/L,故选D.
点评 本题考查了强酸的稀释规律,应注意的是酸溶液无论如何稀释,溶液的pH均不能大于7.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
11.从化学的角度将下列物质进行分类,下列说法正确的是( )
| A. | CO与CO2互为同素异形体 | B. | 金刚石与石墨互为同分异构体 | ||
| C. |  与 与 是同分异构体 | D. | 冰与水互为同分异构体 |
9.已知在干冰晶胞中每个顶角各有1个CO2分子,每个面心各有一个CO2分子.实验测得25℃时干冰晶体的晶胞边长为a cm,其摩尔质量为M g/mol,则该干冰晶体的密度为(单位:g/cm3)( )
| A. | $\frac{4M}{{a}^{3}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
13.某烃的结构简式如图所示,它的正确命名应是( )


| A. | 2-甲基-3-丙基戊烷 | B. | 3-异丙基己烷 | ||
| C. | 2-甲基-3-乙基己烷 | D. | 5-甲基-4-乙基戊烷 |
10.下列说法正确的是( )
| A. | 按系统命名法,化合物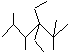 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 酯类物质是形成水果香味的主要成分 |
11.进入化学实验时必须注意安全.下列做法不正确的是( )
| A. | 不慎将酒精灯打翻在实验台上失火时,立即用湿抹布盖灭 | |
| B. | 不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积水,而后边搅拌边慢慢加入浓硫酸 | |
| D. | 做实验时不准直接用手接触药品、不准尝试药品、不准直接闻气体 |
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.反应前后溶液体积不发生变化.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.反应前后溶液体积不发生变化.