题目内容
已知反应A2(g)+2B2(g)?2AB2(g)△H>0,下列说法正确的是( )
| A、升高温度正反应速率加快,逆反应速率减慢 |
| B、0.1 mol A2和0.2 mol B2反应达到平衡时生成0.2 mol AB2 |
| C、达平衡后,升高温度,B的转化率不变 |
| D、催化剂可同等程度地改变正、逆反应速率 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、依据影响反应速率因素分析判断,升温增大反应速率,正逆反应速率增大;
B、反应是可逆反应不能进行彻底;
C、反应是吸热反应,升温平衡正向进行;
D、催化剂改变反应速率,正逆反应速率同等程度改变;
B、反应是可逆反应不能进行彻底;
C、反应是吸热反应,升温平衡正向进行;
D、催化剂改变反应速率,正逆反应速率同等程度改变;
解答:
解:A、升温增大反应速率,正逆反应速率增大,故A错误;
B、反应是可逆反应不能进行彻底,0.1 mol A2和0.2 mol B2反应达到平衡时生成 AB2,小于0.2 mol,故B错误;
C、反应是吸热反应,升温平衡正向进行,B转化率增大,故C错误;
D、催化剂改变反应速率,正逆反应速率同等程度改变,故D正确;
故选D.
B、反应是可逆反应不能进行彻底,0.1 mol A2和0.2 mol B2反应达到平衡时生成 AB2,小于0.2 mol,故B错误;
C、反应是吸热反应,升温平衡正向进行,B转化率增大,故C错误;
D、催化剂改变反应速率,正逆反应速率同等程度改变,故D正确;
故选D.
点评:本题考查了化学平衡影响因素分析判断,主要是反应特征和平衡移动原理的应用,掌握基础是关键,题目较简单.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
现有X、Y两种第ⅤA族元素,下列事实不能说明X的非金属性比Y强的是( )
| A、两种元素所形成的酸的酸性:H3XO4>H3YO4 |
| B、两种元素所形成的气态氢化物的稳定性:XH3>YH3 |
| C、两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5 |
| D、两种元素所形成的气态氢化物的还原性:YH3>XH3 |
关于下图电化学装置中的电极名称、材料及反应均可能正确的是( )


| A、阴极(Cu片)2C1--2e-═Cl2↑ |
| B、正极(石墨棒):Fe3++e-═Fe2+ |
| C、阳极(Cu片):4OH--4e-═2H2O+O2↑ |
| D、负极(Fe钉):Fe-3e-═Fe3+ |
下列有关物质的性质和应用的说法均正确的是( )
| A、二氧化硅能与NaOH溶液反应,不能用玻璃瓶盛放NaOH溶液 |
| B、Cl2能与Ca(OH)2反应,可以用澄清石灰水吸收尾气中的Cl2 |
| C、BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D、Al与Fe2O3能发生铝热反应,可用于焊接钢轨 |
下列物质分离和提纯方法属于化学分离提纯法的是( )
| A、分离沙子和食盐水溶液 |
| B、从氯化钠和硝酸钾的混合物中提纯硝酸钾 |
| C、分离溶于水中的氯化钠 |
| D、将O2和CO2混合气体通过NaOH溶液除去CO2气体 |
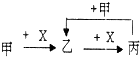 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )| A、甲:Na、X:O2 |
| B、甲:NaOH溶液、X:CO2溶液 |
| C、甲:C、X:O2 |
| D、甲:AlCl3溶液、X:NaOH溶液 |
下列有关说法不正确的是( )
| A、胶体的丁达尔效应与微粒直径大小有关 |
| B、氨气的水溶液能够导电,因此NH3是电解质 |
| C、电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 |
| D、向饱和氯化钠溶液中加入一小块钠,溶液中有固体析出 |
HBr分子的电子式为( )
A、 |
| B、H+Br- |
C、 |
| D、H-Br |
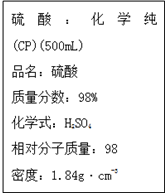 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: