题目内容
下列电离方程式或离子方程式中,正确的是( )
| A、小苏打的电离:NaHCO3?Na++H++CO32- |
| B、苏打溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
| C、FeCl3溶液与Na2S溶液混合:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |
| D、NaAlO2溶液中通入少量CO2气体:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
考点:离子方程式的书写
专题:
分析:A.碳酸钠为强电解质,完全电离用等号,碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
B.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主;
C.不符合反应的客观事实,三价铁离子与硫离子发生氧化还原反应;
D.NaAlO2溶液中通入少量CO2气体,反应生成氢氧化铝和碳酸钠.
B.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主;
C.不符合反应的客观事实,三价铁离子与硫离子发生氧化还原反应;
D.NaAlO2溶液中通入少量CO2气体,反应生成氢氧化铝和碳酸钠.
解答:
解:A.小苏打的电离,离子方程式:NaHCO3=Na++HCO3-,故A错误;
B.苏打溶液呈碱性,离子方程式:CO32-+H2O?HCO3-+OH-,故B错误;
C.FeCl3溶液与Na2S溶液混合,离子方程式:2Fe3++S2-=2Fe2++S↓,故C错误;
D.NaAlO2溶液中通入少量CO2气体,离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故D正确;
故选:D.
B.苏打溶液呈碱性,离子方程式:CO32-+H2O?HCO3-+OH-,故B错误;
C.FeCl3溶液与Na2S溶液混合,离子方程式:2Fe3++S2-=2Fe2++S↓,故C错误;
D.NaAlO2溶液中通入少量CO2气体,离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,注意电解质强弱、盐类水解的规律是解题关键,题目难度不大.

练习册系列答案
相关题目
由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol?L-1,c(SO42-)=0.8mol?L-1,则c(K+)=( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
在恒温恒容的容器里进行下列反应:N2+3H2?2NH3,其他条件不变,向容器中充入氩气,则此反应速率会( )
| A、变大 | B、变小 |
| C、不变 | D、无法判断 |
下列说法正确的是( )
| A、镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
| B、埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀 |
| C、钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-3e-=Fe 3+ |
| D、在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀 |
下列事实中,能用勒沙特列原理来解释的是( )
| A、由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B、久置的氯水变成了稀盐酸 |
| C、在FeCl3溶液中加入铁粉防止氧化变质 |
| D、加入催化剂有利于SO2与O2反应制SO3 |
有机物X、Y分子式不同,它们只含C、H、O元素中的两种或三种,若将X、Y不论何种比例混合,只要物质的量之和不变,完全燃烧时耗氧气量和生成的水的物质的量也不变.X、Y是( )
| A、C2H4、C2H6O |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O |
| D、CH4、C2H4O2 |
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:
2NO(g)?N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
| A、常温下,水分解产生O2,此时平衡常数的值约为5×10-80 | ||
| B、常温下,最易分解放出O2的是水 | ||
C、K3=
| ||
| D、以上都不正确 |
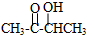 )是一种有奶香味的香料.以丙酮为主要原料合成3-羟基丁酮,并能进一步合成多种高聚物,其中聚对苯二甲酸-2,3-丁二醇酯(PBT)是最坚韧的工程热塑材料之一.合成线路如下:
)是一种有奶香味的香料.以丙酮为主要原料合成3-羟基丁酮,并能进一步合成多种高聚物,其中聚对苯二甲酸-2,3-丁二醇酯(PBT)是最坚韧的工程热塑材料之一.合成线路如下: