题目内容
19.下列各项中表达正确的是( )| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 用电子式表示HCl形成过程: | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
分析 A.第VⅡA族元素的氢化物中,HF中存在氢键,导致其沸点最高;
B.水分子的稳定性取决于O-H键的键能大小;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:A.HF中才氢键,大大增强了分子间作用力,则第VⅡA族元素形成的氢化物中沸点最高的是HF,故A错误;
B.水分子很稳定性是因为水分子间具有较强的H-O键,与氢键无关,故B错误;
C.HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,故C错误;
,故C错误;
D.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小,第三周期移动离子半径先减小后增大,离子半径最小的是Al3+,故D正确;
故选D.
点评 本题考查较为综合,涉及原子结构与元素性质、用电子式表示化合物形成过程、氢键与化学键等知识,题目难度不大,明确氢键与化学键对物质性质的影响为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
9.下列各图表示某些同学从溴水中萃取溴并分液的实验环节(夹持仪器已省略),其中正确的是( )
| A. |  加萃取液 | B. |  放出苯层 | C. |  放出水层 | D. |  处理废液 |
10.如图为原电池示意图,下列说法中正确的是( )


| A. | 锌片是正极 | B. | 铜片是负极 | ||
| C. | 该装置能够将电能转化为化学能 | D. | 电子由锌片通过导线流向铜片 |
7.已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(g);△H=-48.40kJ•mol-1 | |
| B. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-5518kJ•mol-1 | |
| C. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=+5518kJ•mol-1 | |
| D. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-48.40kJ•mol |
14.元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构.以下关于A、B元素性质的比较中,正确的是( )
①原子序数:A>B
②离子半径:aAm+<bBn-
③原子半径:A<B
④元素所在的周期序数:A>B
⑤A的最高正价与B的最低负价的绝对值相等
⑥b=a+m-n.
①原子序数:A>B
②离子半径:aAm+<bBn-
③原子半径:A<B
④元素所在的周期序数:A>B
⑤A的最高正价与B的最低负价的绝对值相等
⑥b=a+m-n.
| A. | ②③④ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
4.关于电解法精炼铜的下列说法正确的是( )
| A. | 电解过程中阴极发生氧化反应 | B. | 电解结束后,溶液中Cu2+浓度变大 | ||
| C. | 粗铜作阳极,硫酸铜为电解质溶液 | D. | 纯铜作阳极,硫酸铜为电解质溶液 |
8.下列说法正确的是( )
| A. | 某溶液$\stackrel{+硝酸银溶液}{→}$生产白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+氯化钡溶液}{→}$生产白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中有CO32- | |
| D. | 某溶液$\stackrel{+氢氧化钠溶液}{→}$生产蓝色沉淀,说明原溶液中有Cu2+ |
 有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为
有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为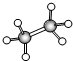 ;C的比例模型为
;C的比例模型为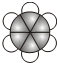 ;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.