题目内容
9.下列叙述错误的是( )| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
分析 A.乙醇与Na反应生成氢气,乙醚不能;
B.甲酸乙酯和丙醛均含-CHO;
C.苯的密度比水小,溴苯密度比水大,均不溶于水;
D.3-己烯含碳碳双键,能被高锰酸钾氧化,而己烷不能.
解答 解:A.乙醇与Na反应生成氢气,乙醚不能,则金属钠可鉴别,故A正确;
B.甲酸乙酯和丙醛均含-CHO,则用新制的银氨溶液不能鉴别甲酸乙酯和丙醛,故B错误;
C.苯的密度比水小,溴苯密度比水大,均不溶于水,则与水混合分层现象不同,可鉴别,故C正确;
D.3-己烯含碳碳双键,能被高锰酸钾氧化,而己烷不能,则用酸性高锰酸钾溶液可鉴别己烷和3-己烯,故D正确;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握有机物的结构与性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
19.在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和4.8g滤渣.下列计算结果正确的是( )
| A. | 4.8g滤渣是由3.2g铜和1.6g铁组成 | B. | ω=14.7 | ||
| C. | 反应过程中产生的氢气是2.24L | D. | 滤液是20.88%的硫酸亚铁溶液 |
20.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
17.下列说法不正确的是( )
| A. | 危化品储存运输过程中发生金属钠、镁着火时,应立即用泡沫灭火器灭火 | |
| B. | 配制银氨溶液的操作:在2 mL 2%的硝酸银溶液中逐滴加入2%的氨水、振荡试管,直至产生的沉淀恰好完全溶解 | |
| C. | 配制230mL 0.1mol•L-1的FeCl3溶液:称取一定质量的FeCl3固体在烧杯中溶于适量盐酸中,放置至室温后,再转移入250mL容量瓶中进行配制 | |
| D. | 取少量硫酸亚铁铵晶体用蒸馏水溶解,加入适量10%的NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,说明晶体中含有NH4+ |
4.汽车已经进入千家万户,汽油来自于石油化工.下列说法不正确的是( )
| A. | 石油中含有1~50个碳原子的烷烃及环烷烃 | |
| B. | 石油分馏是物理变化,裂化、裂解和催化重整属于化学变化 | |
| C. | 石油裂化的目的主要是提高汽油的产量 | |
| D. | 裂化主要是将链烃变为芳香烃 |
5.(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”).
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
①待测NaOH溶液的物质的量浓度为0.1149mol/L.(保留四位有效数字)
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的D.
A.KBr B.KI C.K2S D.K2CrO4.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4.
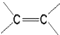 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 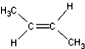 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )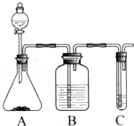 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质: ;
;