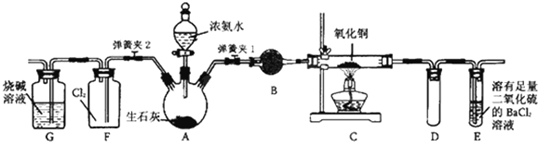
题目内容
12.图中能组成原电池产生电流的是( )| A. |  | B. |  | C. |  | D. |  |
分析 根据原电池的构成条件判断,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答该题.
解答 解:A.两电极相同,不能形成原电池,故A错误;
B.锌为负极,铜为正极,电解质溶液为硫酸,可形成原电池,故B正确;
C.酒精是非是解质,不能形成原电池,故C错误;
D.不能进行自发进行氧化还原反应,不能形成原电池,故D错误.
故选B.
点评 本题考查了原电池的构成条件,侧重于基础知识的考查,注意原电池的这几个条件必须同时具备,缺一不可,题目较简单

练习册系列答案
相关题目
2.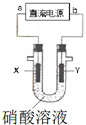 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )| A. | a极为负极,b极为正极 | |
| B. | 电解时,Y极附近溶液pH降低 | |
| C. | 相同条件下,阴阳两极气体体积比是2:1 | |
| D. | X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O |
3.在常温下,用惰性电极电解饱和Na2CO3溶液,下列说法正确的是( )
| A. | 溶液的pH值不变 | B. | 溶液中Na2CO3的物质的量不变 | ||
| C. | Na+与CO32-数目不变 | D. | Na2CO3溶液的浓度不变 |
20.反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,将气体混合物的温度升高,下列叙述正确的是( )
| A. | 正反应速率和逆反应速率都增大,平衡向逆反应方向移动 | |
| B. | 正反应速率和逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
17.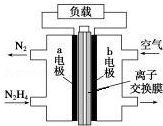 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )| A. | b 极发生还原反应 | |
| B. | a 极的反应式为 N2H4-4e-═N2↑+4H+ | |
| C. | 放电时,电流从 b 极经过负载流向 a 极 | |
| D. | 其中的离子交换膜需选用阴离子交换膜 |
4.近年来我国很多城市发生严重的雾霾天气,对人们的健康造成威胁,下列有关环境问题的说法不正确的是( )
| A. | 改进汽车尾气净化技术,可以减少大气污染物的排放 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气产生的主要原因 | |
| C. | 推广燃煤脱硫技术,可以降低SO2对大气的污染 | |
| D. | CO、SO2、NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在 |
1.材料与化学密切相关.下列物质与用途对应关系不正确的是( )
| A. | 碘化钾--加碘盐 | B. | 氧化铝--耐火材料 | ||
| C. | 铁碳合金--碳素钢 | D. | 硅酸盐--普通玻璃 |
2.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(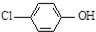 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
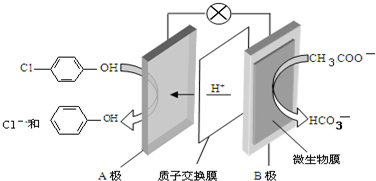
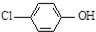 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
| A. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| B. | A极的电极反应式为 +e-=Cl-+ +e-=Cl-+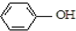 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |