��Ŀ����
7����ͼ��ʾ����ʵ���ҽ��а��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������
��1������װ��װ�ú���Ҫ����A-Eװ�õ������ԣ���������ȹرյ��ɼ�2�ͷ�Һ©�����������ɼ�1
����E�м�ˮ����û������ĩ�ˣ�Ȼ����A���쵽E��������ð�����ƿ��ƾ��ƣ�E�е�����ˮ���γ�˵��װ�����������ã�
��2������ƽ���ƶ���ԭ������A����ȡ������ԭ��������ʯ������Ũ��ˮ����ˮ���ų��������ȴ�ʹNH3�ӷ�����Һ��OH-Ũ�����ӣ�����ʹNH3+H2O?NH3•H2O?NH4++OH-������NH3�ƶ����ӿ찱���ݳ���
��3��װ��B��ʢ���Լ��Ǽ�ʯ�ң�
��4���رյ��ɼ�2�����ɼ�1���ӷ�Һ©���ų�Ũ��ˮ����û��ƿ�й����رշ�Һ©����������ȼC���ƾ��ƣ�װ��C�к�ɫ������죬װ��E��������ð��
��������ɫ��������������E���ݳ�Һ����������ֱ�������������д����C�з�����Ӧ�Ļ�ѧ����ʽ2NH3+3CuO$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+N2��+3H2O��
��5����C�й���ȫ�����ɫ�رյ��ɼ�1�������ƿ��ƾ��ƣ�����ȴ����C�й�������������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ͨ������ȷ���ù������ijɷ���Cu2O��Cu��
��6���ڹرյ��ɼ�1���ɼ�2�������������F�У��ܿ췢��װ��F�в������̣�ͬʱ����G����ҺѸ�ٵ�������F�У�д���������̵Ļ�ѧ����ʽ3Cl2+8NH3=N2+6NH4Cl��Ѹ�ٲ���������ԭ����ʢ�������ļ���ƿ�����������������ɲ��ֹ��壬������ѹ��С��������Һ������
���� ��1����װ��װ�ú���Ҫ����A-Eװ�õ������ԣ�������ǣ����ȹرյ��ɼ�2�ͷ�Һ©�����������ɼ�1����E��װ��ˮ��Ȼ����A���۲쵽E��������ð�����ƿ��ƾ��ƻ��ɿ�˫�֣�E�е�����ˮ���γ�˵��װ�����������ã�
��2������װ��ͼ��֪��A�н�Ũ��ˮ���뵽��ʯ���У�������ʯ������Ũ��ˮ����ˮ���ų��������ȴ�ʹNH3�ӷ���ͬʱ��Һ�д���ƽ��NH3+H2O?NH3•H2O?NH4++OH-��OH-Ũ�����ӣ�ƽ��������NH3�ƶ����ݴ˴��⣻
��3������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�ң�
��4����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ��
װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��
��5�����ɵĺ�ɫ���ʿ���ΪCu2O��Cu���������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g-2.4g=13.6g������ʣ�������Cu����Ԫ������ȷ����ɣ���������n��Cu����n��O��ȷ����ɣ�
��6��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl��
ʢ�������ļ���ƿ�����������������ɲ��ֹ��壬������ѹ��С��������Һ������
��� �⣺��1����װ��װ�ú���Ҫ����A-Eװ�õ������ԣ�������ǣ����ȹرյ��ɼ�2�ͷ�Һ©�����������ɼ�1����E��װ��ˮ��Ȼ����A���۲쵽E��������ð�����ƿ��ƾ��ƻ��ɿ�˫�֣�E�е�����ˮ���γ�˵��װ�����������ã�
�ʴ�Ϊ���رյ��ɼ�2�ͷ�Һ©�����������ɼ�1����E�м�ˮ����û������ĩ�ˣ�
��2������װ��ͼ��֪��A�н�Ũ��ˮ���뵽��ʯ���У�������ʯ������Ũ��ˮ����ˮ���ų��������ȴ�ʹNH3�ӷ�����Һ��OH-Ũ�����ӣ�����ʹNH3+H2O?NH3•H2O?NH4++OH-������NH3�ƶ����ӿ찱���ݳ���
�ʴ�Ϊ��������ʯ������Ũ��ˮ����ˮ���ų��������ȴ�ʹNH3�ӷ�����Һ��OH-Ũ�����ӣ�����ʹNH3+H2O?NH3•H2O?NH4++OH-������NH3�ƶ����ӿ찱���ݳ���
��3������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�ң�
�ʴ�Ϊ����ʯ�ң�
��4����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ���ʻ��а�ɫ������������������Ϊ������ð����������ɫ������װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+N2��+3H2O��
�ʴ�Ϊ��������ð����������ɫ������2NH3+3CuO$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+N2��+3H2O��
��5��16gCuO�к���CuԪ������Ϊ16g��$\frac{64}{80}$=12.8g��������Ԫ������Ϊ16g-12.8g=3.2g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g-2.4g=13.6g������12.8g����ʣ����庬��Cu��OԪ�أ���n��Cu��=$\frac{12.8g}{64g/mol}$=0.2mol������OԪ�ص�����Ϊ13.6g-12.8g=0.8g��n��O��=$\frac{0.8g}{16g/mol}$=0.05mol��n��Cu����n��O��=0.2mol��0.05mol=4��1��2��1����ʣ�����ΪCu2O��Cu��
�ʴ�Ϊ��Cu2O��Cu��
��6��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl����Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl��ʢ�������ļ���ƿ�����������������ɲ��ֹ��壬������ѹ��С��������Һ������
�ʴ�Ϊ��3Cl2+8NH3=N2+6NH4Cl��ʢ�������ļ���ƿ�����������������ɲ��ֹ��壬������ѹ��С��������Һ������
���� ���⿼�鰱�����Ʊ�������ʵ�顢��װ�õ����⡢ʵ���������ѧ����ȣ��Ѷ��еȣ��������ʵ���������ԭ���ǽ���Ĺؼ����Ƕ�֪ʶ���ۺϿ��飬��Ҫѧ��������ʵ�Ļ�����������⡢��������������

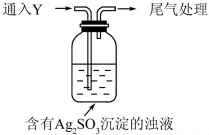 ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽����
ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽������1�����Na2SO3��ҺpH=10��AgNO3��ҺpH=5�����߷���ˮ������ӷֱ���SO32-��Ag+��
��2������pH��ʵ���¼���£�
| ʵ�� | pH | ���� |
| A | 10 | ������ɫ�������Ժ��ܽ⣬��Һ���� |
| B | 6 | ������ɫ������һ��ʱ�����δ�ܽ� |
| C | 2 | ����������ɫ������һ��ʱ���������״�غ�ɫ����X |
��Ag2SO3����ɫ��������ˮ�����ڹ���Na2SO3����Һ
��Ag2O���غ�ɫ��������ˮ���ܺ��ᷴӦ���������ᷴӦ�Ļ�ѧ����ʽΪ��Ag2O+2HCl=2AgCl+H2O��
��3����ͬѧ�Ʋ�a�а�ɫ����ΪAg2SO4�������ǿ����е��������ܲ��뷴Ӧ�����������������������ӷ���ʽΪ2Ag++O2+2SO32-=Ag2SO4��+SO42-��
��ͬѧ���ʵ��ȷ����A��B��C�еİ�ɫ��������Ag2SO4��ʵ�鷽���ǣ�ȡB��C�а�ɫ����������Na2SO3��Һ�У������ܽ⣮��ȡAg2SO4������������Na2SO3��Һ�У�δ�ܽ⣮
��4����C��X�˳���ϴ����Ϊȷ������ɣ�ʵ�����£�
I����X�еμ�ϡ���ᣬ�����Ա仯
����X�м������ŨHNO3����������ɫ����
����Ba��NO3��2��Һ��BaCl2��Һ������з�Ӧ�����Һ��ǰ���ޱ仯�����߲�����ɫ����
��ʵ��I��Ŀ����֤��X����Ag2O��
�ڸ���ʵ��������X��Ag��
�ۢ��з�Ӧ�Ļ�ѧ����ʽ��Ag+2HNO3��Ũ��=AgNO3+NO2��+H2O��
��5����ͬѧ�ۺ�����ʵ�飬��������X��ԭ����Ϊ�������Ե���ǿ��+4����Ļ�ԭ����ǿ���ܱ�+1����������ͨ����һ��ʵ��ȷ�������ֿ����ԣ�ʵ�����£�
��ͨ��Y��ƿ�а�ɫ����ת��Ϊ�غ�ɫ������Y��SO2��
�ڰ�ɫ����ת��ΪX�Ļ�ѧ����ʽ��Ag2SO3+H2O$\stackrel{H+}{��}$2Ag+H2SO4��
| A�� | ʵ��������ˮ�ͱ��ڴ������������屽��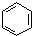 +Br2$\stackrel{FeBr_{3}}{��}$ +Br2$\stackrel{FeBr_{3}}{��}$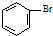 +HBr +HBr | |
| B�� | ����������H${\;}_{2}^{18}$O��������ˮ�ⷴӦ��CH3COOC2H5+H-18OH $?_{��}^{��}$CH3CO18OH+C2H5OH | |
| C�� | ��������Һ��ͨ������������̼�����ӷ���ʽ��2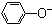 +CO2+H2O�� +CO2+H2O��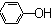 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D�� | ��ȩ��Һ��������������Һ���ȣ�HCHO+2[Ag��NH3��2]OH$\stackrel{��}{��}$HCOONH4+2Ag��+3NH3+H2O |
 ��C1��ѧ����ָ��̼���ʻ�����к�1��̼ԭ�ӵ����ʣ���CO��CO2��CH4��CH3OH�ȣ�Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ���գ��Կ�������Դ�Ϳ��ƻ�����Ⱦ����Ҫ���壮
��C1��ѧ����ָ��̼���ʻ�����к�1��̼ԭ�ӵ����ʣ���CO��CO2��CH4��CH3OH�ȣ�Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ���գ��Կ�������Դ�Ϳ��ƻ�����Ⱦ����Ҫ���壮��1�������Ϊ 2L���ܱ������г���1mol CO��2mol H2����һ�������·������·�Ӧ��CO��g��+2H2��g��?CH3OH��g��������t��ﵽƽ�⣬ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش�
��p1��T1��ʱ���ӿ�ʼ��ƽ��Ĺ����У���H2��ʾ��ƽ����Ӧ����Ϊ$\frac{0.5}{t}$mol•L-1•s-1
��ͼ��ѹǿp1�� ѹǿp2�������������������=����
��2��һ���¶��£������������Ϊ 1.0L�ĺ����ܱ������з������·�Ӧ��2CH3OH��g��?CH3OCH3��g��+H2O��g��
| ���� ��� | �¶ȣ��棩 | ��ʼ�����ʵ�����mol�� | ƽ������ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| �� | 387 | 0.40 | ||
| �� | 207 | 0.20 | 0.090 | 0.090 |
�ڴﵽƽ��ʱ������I�е�CH3OH�����������ȣ�����ڡ�����С�ڡ�����ȡ����������е�CH3OH�����������
������ʼʱ������I�г���CH3OH 0.1mol��CH3OCH30.15mol��H2O 0.10mol����Ӧ��������Ӧ������У������Ӧ�������淴Ӧ�����ƶ�������
��3��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��������Ӧ�ں��ݾ��ȣ���
����罻�������������½��У����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ�
| ���� | CO2 | H2 | CH3OH | H2O |
| ��ʼͶ��/mol | 1 | 3 | 2 | 0 |
| A�� |  | B�� |  | C�� |  | D�� |  |
| A�� | Fe��Mg��0.1 mol•L-1�����ᷴӦ����Ӧ������ͬ | |
| B�� | 0.1 mol•L-1��������H2SO4�ֱ����С����״��ͬ�Ĵ���ʯ��Ӧ����Ӧ������ͬ | |
| C�� | �����ܽ��ͷ���ʱ����������ʹ��λ����ڻ���Ӱٷ���������� | |
| D�� | 100Ml 2mol•L-1��������пƬ��Ӧ������������NaCl��Һ����Ӧ���ʲ��� |
| A�� | ����Ͷ�뵽NaOH��Һ�У�2Al+2OH-�T2AlO2-+H2�� | |
| B�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| C�� | ���Ȼ�����Һ�м������ۣ�2Fe3++Fe�T3Fe2+ | |
| D�� | ͭƬ����ϡ�����в������壺Cu+4H++2NO3-�TCu2++2NO2��+2H2O |
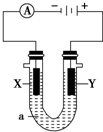 X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��
X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��