题目内容
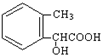
7.某有机化合物A的结构简式如图所示: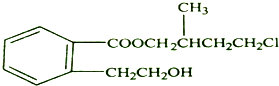
回答下列问题:
(1)A的分子式为C14H19O3Cl.
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,C则的结构简式是
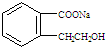 .
.(3)C酸化后可得F,F不能发生的反应类型是d(填写字母代号).
a.取代反应 b.加成反应 c.消去反应 d.加聚反应 e.氧化反应 f.还原反应
(4)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为60g/mol.
(5)F可以发生如下转化,且G与H互为同分异构体.
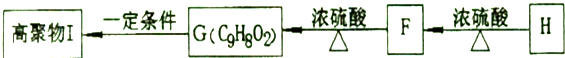
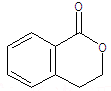
请写出:①H的结构简式
 .②由F生成的G化学方程式
.②由F生成的G化学方程式 .
.(6)符合下列三个条件的F的同分异构体的数目有多种,任写出其中1种的结构简式
 .
.①有邻二取代苯环结构;②F具有相同的官能团;③不与FeCI3溶液发生显色反应.
分析 (1)由结构简式可知分子式;
(2)A中含-COOC-可发生水解反应,C中含苯环;
(3)C酸化后可得F,F中含-COOH、-OH,结合羧酸、醇及苯的性质分析;
(4)B为CH3CH(OH)CH2CH2OH,酯化反应中M(B)+2M(D)=M(E)+2M(H2O);
(5)由转化关系可知,F→H发生分子内酯化反应,F→G发生醇的消去反应,G→I发生加聚反应;
(6)F的同分异构体符合:①含有邻二取代苯环结构②与F具有相同的官能团 ③不与FeCl3溶液发生显色反应,则邻位2个取代基上含1个-OH、1个-COOH,-OH、-COOH可均在同一个取代基上.
解答 解:(1)由结构简式可知分子式为C14H19O3Cl,故答案为:C14H19O3Cl;
(2)A中含-COOC-可发生水解反应,C中含苯环,则C的结构简式为 ,故答案为:
,故答案为: ;
;
(3)C为 ,C酸化后可得F,F中含-COOH、-OH,则
,C酸化后可得F,F中含-COOH、-OH,则
a.含-OH、-COOH,可发生取代反应,故不选;
b.含苯环,可发生加成反应,故不选;
c.含-OH,可发生消去反应,故不选;
d.不含双键或三键,不能发生加聚反应,故选;
e.哈-OH,可发生氧化反应,故不选;
故答案为:d;
(4)B为CH3CH(OH)CH2CH2OH,酯化反应中M(B)+2M(D)=M(E)+2M(H2O),则M(D)=$\frac{84+2×18}{2}$=60g/mol,故答案为:60g/mol;
(5)①由转化关系可知,F→H发生分子内酯化反应,则H为 ,故答案为:
,故答案为: ;
;
②F→G发生醇的消去反应,该反应为 ,
,
故答案为: ;
;
(6)F的同分异构体符合:①含有邻二取代苯环结构②与F具有相同的官能团 ③不与FeCl3溶液发生显色反应,则邻位2个取代基上含1个-OH、1个-COOH,-OH、-COOH可均在同一个取代基上,如 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与推断能力、综合应用能力的考查,(6)为解答的难点,题目难度中等.

| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
| A. | 2a | B. | (2+$\frac{S}{100}$)a | C. | $\frac{200a}{100-S}$ | D. | (1+$\frac{S}{50}$)a |
| A. | 37Cl与39K具有相同的中子数 | |
| B. | 第114号元素的一种核素${\;}_{114}^{298}X$与${\;}_{82}^{207}Pb$具有相同的最外层电子数 | |
| C. | O22-与S2-具有相同的质子数和电子数 | |
| D. | H3O+与OH-具有相同的质子数和电子数 |
| A. | 将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向氯化铝溶液中加入足量氨水:AI3++4NH3•H2O=AIO2-+2H2O+4NH4+ | |
| D. | 向Ca(OH2)溶液中通入过量SO2:SO2+OH-=HSO3- |
①微粒半径:Cl->S2->S>F ②稳定性:HF>HCl>H2S
③还原性:Cl->Br->I- ④氧化性:Cl2>S
⑤酸性:H2SO4>HClO4 ⑥沸点:HF>HCl>HBr>HI.
| A. | 只有① | B. | ①③④ | C. | ②④ | D. | 只有⑥ |
①O2 N2 Cu Si ②HCl HBr H2S HNO3③CaO Na2O CuO Al2O3
④NH4Cl NaOH NaAlO2 K2CO3
(1)填写下表空白:
| 组 | ①组 | ②组 | ③组 | ④组 |
| 分类标准 | 非金属 | 无氧酸 | 碱性氧化物 | |
| 异类物质 | NaOH |
A 树状分类法 B 交叉分类法
(3)若表中①②组物质反应生成0.6molNO,则转移的电子数目为0.18NA.起酸性作用的HNO3物质的量为1.8mol.
(4)写出表中③④组物质反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.093mol/L(保留两位有效数字)
③NaOH溶液要使用下面哪个仪器乙(填甲 或乙).
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D、F.(多选扣分)(选对一个得2分,多选错选不得分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
