题目内容
12.下列结论是从某同学的笔记本上摘录的,你认为其中肯定正确的是( )①微粒半径:Cl->S2->S>F ②稳定性:HF>HCl>H2S
③还原性:Cl->Br->I- ④氧化性:Cl2>S
⑤酸性:H2SO4>HClO4 ⑥沸点:HF>HCl>HBr>HI.
| A. | 只有① | B. | ①③④ | C. | ②④ | D. | 只有⑥ |
分析 ①同一元素的离子半径中,阴离子半径大于原子半径,阳离子半径小于原子半径,同一周期元素,原子半径随着原子序数增大而减小;
②元素的非金属性越强,其氢化物的稳定性越强;
③元素的非金属性越强,其简单阴离子的还原性越弱;
④元素的非金属性越强,其单质的氧化性越强;
⑤元素的非金属性越强,其最高价氧化物的水化物酸性越强;
⑥氢化物都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,但含有氢键的物质熔沸点较高.
解答 解:①同一元素的离子半径中,阴离子半径大于原子半径,阳离子半径小于原子半径,同一周期元素,原子半径随着原子序数增大而减小,所以半径,故S2->Cl->S>F,故错误;
②元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S,所以氢化物的稳定性HF>HCl>H2S,故正确;
③元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>Br>I,所以简单阴离子的还原性Cl-<Br-<I-,故错误;
④元素的非金属性越强,其单质的氧化性越强,非金属性Cl>S,所以单质的氧化性Cl2>S,故正确;
⑤元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S,所以酸性:H2SO4<HClO4,故错误;
⑥氢化物都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,但含有氢键的物质熔沸点较高,HF中含有氢键,熔沸点最高,所以熔沸点HF>HI>HBr>HCl,故错误;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期同一主族元素性质递变规律是解本题关键,注意规律中的反常现象,注意卤族氢化物中HF熔沸点最高,为易错点.

练习册系列答案
相关题目
20.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:(其中一种物质为复盐)
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-.
(4)向D的溶液中加入过量氨水反应的离子方程式为Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3.H2O?[Cu(NH3)4]2++2OH-+4H2O.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-.
(4)向D的溶液中加入过量氨水反应的离子方程式为Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3.H2O?[Cu(NH3)4]2++2OH-+4H2O.
17.下列反应不能用离子方程式:CO32-+2H+═CO2↑+H2O表示的是( )
| A. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | B. | (NH4)2CO3+2HCl═2NH4Cl+H2O+CO2↑ | ||
| C. | K2CO3+H2SO4═K2SO4+CO2↑+H2O | D. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O |
4.下列各组物质中,化学键类型完全相同的是( )
| A. | NH3和N2 | B. | H2O2和NH4Cl | C. | CO2和PCl3 | D. | H2S和Na2O2 |
1.电解质溶液中,下列叙述正确的是( )
| A. | 阳离子和阴离子数目一定相等 | |
| B. | 阳离子带的正电荷总数一定等于阴离子所带的负电荷总数 | |
| C. | 除阴、阳离子外溶液中不会再有其它粒子 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液 |
7.某实验小组用图2所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)反应原理(图1):

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
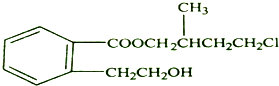
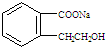 .
.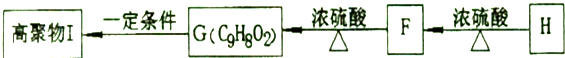
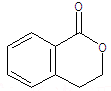 .②由F生成的G化学方程式
.②由F生成的G化学方程式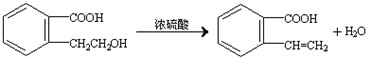 .
.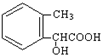 .
.