题目内容
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去).已知:常温下,CO能使一些化合物中的金属离子还原.例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在.
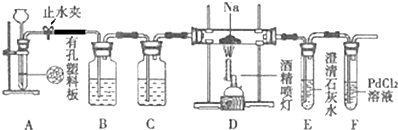
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 .
(2)检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置 (填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 .
(3)待反应完全后,停止加热,仍继续通二氧化碳,直至反应管冷却.停止加热前是否需要先断开D和E的连接处?为什么? .
(4)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,则钠与二氧化碳反应的化学方程式是 .
②若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,则钠与二氧化碳反应的化学方程式是 .

请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是
(2)检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是
(3)待反应完全后,停止加热,仍继续通二氧化碳,直至反应管冷却.停止加热前是否需要先断开D和E的连接处?为什么?
(4)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,则钠与二氧化碳反应的化学方程式是
②若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,则钠与二氧化碳反应的化学方程式是
考点:性质实验方案的设计
专题:实验设计题
分析:装置A:为二氧化碳发生装置,CaCO3+2H+=Ca2++H2O+CO2↑;装置B:用饱和的碳酸氢钠溶液,除去二氧化碳中的HCl,装置C:为干燥装置,用浓H2SO4吸收二氧化碳中的水蒸气,装置D:钠与二氧化碳反应,可能发生4Na+3CO2
2Na2CO3+C或2Na+2CO2
Na2CO3+CO;钠为活泼金属,反应需要排尽装置内的空气,装置E:当E装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热D处的酒精灯发生反应;装置F:若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,发生:4Na+3CO2
2Na2CO3+C;若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,发生2Na+2CO2
Na2CO3+CO;
(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,制得的二氧化碳中含有氯化氢和水蒸气,利用装置B除氯化氢,利用装置C除水蒸气,根据除杂物质选择试剂;
(2)为避免空气的影响,实验前先通二氧化碳充满装置后,再点燃酒精喷灯;
(3)根据该实验的实验步骤中的注意事项考虑:实验完毕不能立即停止通二氧化碳,实验结束后持续通入二氧化碳,不会使液体倒吸,不需要断开;
(4)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
②装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO.
| ||
| ||
| ||
| ||
(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,制得的二氧化碳中含有氯化氢和水蒸气,利用装置B除氯化氢,利用装置C除水蒸气,根据除杂物质选择试剂;
(2)为避免空气的影响,实验前先通二氧化碳充满装置后,再点燃酒精喷灯;
(3)根据该实验的实验步骤中的注意事项考虑:实验完毕不能立即停止通二氧化碳,实验结束后持续通入二氧化碳,不会使液体倒吸,不需要断开;
(4)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
②装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO.
解答:
解:装置A:为二氧化碳发生装置,CaCO3+2H+=Ca2++H2O+CO2↑;装置B:用饱和的碳酸氢钠溶液,除去二氧化碳中的HCl,装置C:为干燥装置,用浓H2SO4吸收二氧化碳中的水蒸气,装置D:钠与二氧化碳反应,可能发生4Na+3CO2
2Na2CO3+C或2Na+2CO2
Na2CO3+CO;钠为活泼金属,反应需要排尽装置内的空气,装置E:当E装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热D处的酒精灯发生反应;装置F:若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,发生:4Na+3CO2
2Na2CO3+C;若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,发生2Na+2CO2
Na2CO3+CO;
(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;制得的二氧化碳中含有氯化氢和水蒸气,利用装置B饱和NaHCO3除氯化氢,利用装置C浓H2SO4除水蒸气;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;饱和NaHCO3;浓H2SO4;
(2)为了避免空气中氧气、水蒸气影响探究二氧化碳和钠反应的产物分析,需要先把装置中空气排出,所以打开Ⅲ的导气管活塞,先通一会CO2气体,使装置充满二氧化碳气体后再点燃酒精喷灯;
故答案为:打开止水夹;E;澄清的石灰水变浑浊;排出该装置中的空气;
(3)该实验推测活泼金属钠也能与CO2发生反应,实验完毕不能立即停止通二氧化碳,实验结束后持续通入二氧化碳,直至反应管冷却,所以E中的溶液不会倒吸到D管,不需要断开,
故答案为:不需要,因为有二氧化碳不断地通入,所以E中的溶液不会倒吸到D管;
(4)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2
2Na2CO3+C,
故答案为:4Na+3CO2
2Na2CO3+C;
②由题意可知,装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO,反应的化学方程式为2Na+2CO2
Na2CO3+CO,故答案为:2Na+2CO2
Na2CO3+CO.
| ||
| ||
| ||
| ||
(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;制得的二氧化碳中含有氯化氢和水蒸气,利用装置B饱和NaHCO3除氯化氢,利用装置C浓H2SO4除水蒸气;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;饱和NaHCO3;浓H2SO4;
(2)为了避免空气中氧气、水蒸气影响探究二氧化碳和钠反应的产物分析,需要先把装置中空气排出,所以打开Ⅲ的导气管活塞,先通一会CO2气体,使装置充满二氧化碳气体后再点燃酒精喷灯;
故答案为:打开止水夹;E;澄清的石灰水变浑浊;排出该装置中的空气;
(3)该实验推测活泼金属钠也能与CO2发生反应,实验完毕不能立即停止通二氧化碳,实验结束后持续通入二氧化碳,直至反应管冷却,所以E中的溶液不会倒吸到D管,不需要断开,
故答案为:不需要,因为有二氧化碳不断地通入,所以E中的溶液不会倒吸到D管;
(4)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2
| ||
故答案为:4Na+3CO2
| ||
②由题意可知,装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO,反应的化学方程式为2Na+2CO2
| ||
| ||
点评:本题考查了物质性质的实验设计验证分析应用,主要是钠及其化合物性质的判断理解,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
以惰性电极电解CuSO4溶液.若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为( )
| A、0.64 g |
| B、1.28 g |
| C、2.56 g |
| D、5.12 g |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、明矾溶液中K+和Al3+的物质的量浓度相等 |
| B、1mol 羟基和17g NH3所含的电子数相等 |
| C、常温常压下,l6gO2和16gO3中所含原子数均为NA |
| D、电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g |
烧碱、醋酸和碳酸氢钠等是生活中的常见物质.下列有关它们的表述正确的是( )
| A、将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、将0.1 mol?L-1 CH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、溶液的pH都逐渐增大 |
| C、在碳酸氢钠溶液中加入与其等物质的量的烧碱,溶液中的阴离子只有CO32-和OH- |
| D、常温下,将pH=12的烧碱溶液与pH=2的醋酸溶液等体积混合,所得混合液的pH>7 |
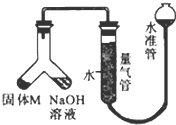 某课外兴趣小组为探究某种铝合金(合金元素为Mg 和Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg 和Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验.