题目内容
2.下列离子方程式正确的是( )| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
分析 A.反应生成硫酸亚铁和氢气;
B.反应生成氯化铝和水;
C.电子不守恒;
D.电子、电荷不守恒.
解答 解:A.铁与稀硫酸反应的离子反应为 Fe+2H+═Fe2++H2↑,故A错误;
B.氢氧化铝与足量盐酸反应的离子反应为Al(OH)3+3H+═Al3++3H2O,故B正确;
C.钠和冷水反应的离子反应为2Na+2H2O═2Na++H2↑+2OH-,故C错误;
D.铜片与稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
12.下列叙述正确的是( )


| A. | 如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极 | |
| B. | 如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成 | |
| C. | 基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应 | |
| D. | 若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜 |
10.下列事实一定能说明HF是弱酸的是( )
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
| A. | ①② | B. | ③⑤ | C. | ④⑥ | D. | ②④ |
17.在透明水溶液中能大量共存的一组离子是( )
| A. | 酸溶液中Na+、Ba2+、Cl-、NO3-K+ Fe3+ | |
| B. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
7.下列关于水的说法错误的是( )
| A. | 蒸馏法是海水淡化的方法之一 | |
| B. | 长期饮用纯净水,可能会引起一些微量元素的缺乏 | |
| C. | 含有细菌的水可以用臭氧杀菌 | |
| D. | 含有重金属离子的废水用可以用明矾处理 |
11.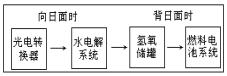 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极有O2放出 | |
| D. | 燃料电池放电时的负极反应:H2+2OH--2e-=2H2O |
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).