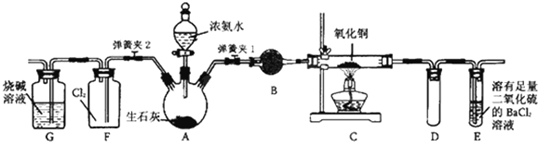
题目内容
15.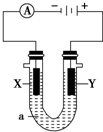 X、Y都是惰性电极,a是饱和NaCl溶液.
X、Y都是惰性电极,a是饱和NaCl溶液.①电解过程X极上的电极反应式为2H++2e-═H2↑;
②用离子方程式表达该电池反应2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2 OH-.
分析 X为阴极,Y为阴极,阴极发生还原反应,氢离子获得电子生成氢气,阳极发生氧化反应,氯离子失去电子生成氯气.
解答 解:X为阴极,Y为阴极,阴极发生还原反应,氢离子获得电子生成氢气,阳极发生氧化反应,氯离子失去电子生成氯气.
①电解过程X极上的电极反应式为:2H++2e-═H2↑;
②用离子方程式表达该电池反应:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2 OH-,
故答案为:2H++2e-═H2↑;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2 OH-.
点评 本题考查电解原理,关键是理解掌握离子放电顺序,电解原理本质是氧化还原反应,理解掌握阳极、阳极发生的电极反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体 |
6.下列实验需要用水浴加热的是( )
| A. | 苯酚的显色反应 | B. | 乙酸乙酯的水解 | ||
| C. | 用乙醇制乙烯 | D. | 乙醛与银氨溶液的反应 |
3.在常温下,用惰性电极电解饱和Na2CO3溶液,下列说法正确的是( )
| A. | 溶液的pH值不变 | B. | 溶液中Na2CO3的物质的量不变 | ||
| C. | Na+与CO32-数目不变 | D. | Na2CO3溶液的浓度不变 |
10.一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)?2SCl2(鲜红色液体)△H=-61.16kJ•mol-1.下列说法正确的是( )
| A. | 增大压强,平衡常数将增大 | |
| B. | 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 | |
| C. | 达到平衡时,若升高温度,氯气的百分含量减小 | |
| D. | 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
20.反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,将气体混合物的温度升高,下列叙述正确的是( )
| A. | 正反应速率和逆反应速率都增大,平衡向逆反应方向移动 | |
| B. | 正反应速率和逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
4.近年来我国很多城市发生严重的雾霾天气,对人们的健康造成威胁,下列有关环境问题的说法不正确的是( )
| A. | 改进汽车尾气净化技术,可以减少大气污染物的排放 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气产生的主要原因 | |
| C. | 推广燃煤脱硫技术,可以降低SO2对大气的污染 | |
| D. | CO、SO2、NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在 |
5.一定温度下,水存在电离平衡H2O(l)?H+(aq)+OH-(aq)△H>0,下列叙述一定正确的是( )
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |