题目内容
【题目】Q、W、X、Y、Z五种短周期元素在周期表中的相对位置如下图所示,其中W的单质是一种重要半导体材料。
|
|
| Y |
|
Q | W | X |
| Z |
请按要求回答下列问题:
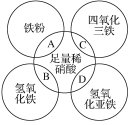
(1)Y的原子结构示意图为________;举一例说明Z的非金属性比X的非金属性强的事实:________。
(2)W、X、Y的原子半径由大到小依次![]() 填元素符号
填元素符号![]() ________:W与Z形成的化合物电子式为________。
________:W与Z形成的化合物电子式为________。
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为________。
(4)已知: 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×10-12,则R(OH)2饱和溶液中c(OH-)=________mol/L。
【答案】 酸性强弱:HClO4>H3PO4 r(Si)>r(P)>r(O)
酸性强弱:HClO4>H3PO4 r(Si)>r(P)>r(O) ![]() 2Fe2++2 Br-+2Cl2=2Fe3++Br2+4Cl- Na2O(s)+
2Fe2++2 Br-+2Cl2=2Fe3++Br2+4Cl- Na2O(s)+![]() O2(g)=Na2O2(s)H=-97kJ/mol,而S <0,H-TS <0时,反应可自发进行 2 Na2O2+ AlCl3= NaAlO2+3NaCl+ O2↑ 2.0×10-4
O2(g)=Na2O2(s)H=-97kJ/mol,而S <0,H-TS <0时,反应可自发进行 2 Na2O2+ AlCl3= NaAlO2+3NaCl+ O2↑ 2.0×10-4
【解析】
由短周期元素的相对位置,可知Y处于第二周期,其它处于第三周期,而W的单质是一种重要半导体材料,则W为Si元素,可推知Q为Al,X为P,Y为O,Z为Cl。
(1)Y为O元素,原子结构示意图为:![]() ,酸性强弱:HClO4>H3PO4,或稳定性:HCl>PH3等都可以说明Cl的非金属性比P的强;
,酸性强弱:HClO4>H3PO4,或稳定性:HCl>PH3等都可以说明Cl的非金属性比P的强;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:r(Si)>r(P)>r(O),W与Z形成的化合物为SiCl4,Si原子与每个Cl原子之间都形成1对共用电子对,电子式为: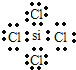 ;
;
(3)假设氯气与FeBr2均为1mol,还原性Fe2+>Br-,氯气先氧化Fe2+为Fe3+,根据电子转移守恒,1mol Fe2+消耗0.5mol氯气,而剩余的0.5mol氯气可以氧化1mol Br-,反应离子方程式为2Fe2++2 Br-+2Cl2=2Fe3++Br2+4Cl- ;
![]() 已知:①2Na(s)+
已知:①2Na(s)+![]() O2(g)=Na2O(s)H=-414kJ/mol;②2Na(s)+O2(g)=Na2O2(s)H=-511kJ/mol;根据盖斯定律,②-①可得:Na2O(s)+
O2(g)=Na2O(s)H=-414kJ/mol;②2Na(s)+O2(g)=Na2O2(s)H=-511kJ/mol;根据盖斯定律,②-①可得:Na2O(s)+![]() O2(g)=Na2O2(s)H=-97kJ/mol,该反应S<0,而H-TS <0时,反应可自发进行,故低温下可以自发进行,将0.2mol Na2O2加入到100mL1mol/L的AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2,故反应方程式为:2 Na2O2+ AlCl3= NaAlO2+3NaCl+ O2↑;
O2(g)=Na2O2(s)H=-97kJ/mol,该反应S<0,而H-TS <0时,反应可自发进行,故低温下可以自发进行,将0.2mol Na2O2加入到100mL1mol/L的AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2,故反应方程式为:2 Na2O2+ AlCl3= NaAlO2+3NaCl+ O2↑;
(5)Ksp[R(OH)2]=c(R2+)×c2(OH-)=4.0×10-12,而饱和溶液中c(R2+)=![]() c(OH-),联立可得饱和溶液中c(OH-)=2.0×10-4。
c(OH-),联立可得饱和溶液中c(OH-)=2.0×10-4。