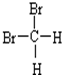
题目内容
10.1.5mol C2H5OH的质量是69g,其中含有9mol H,含有24g氧元素.分析 根据m=nM计算出1.5mol乙醇分子的质量;乙醇分子中含有6个H原子、1个O原子,据此计算出该乙醇中含有氢原子的物质的量、氧原子的物质的量,再根据m=nM计算出含有氧元素的质量.
解答 解:1.5mol C2H5OH的质量是:46g/mol×1.5mol=69g;
1.5mol C2H5OH中含有氢原子的物质的量为:1.5mol×6=9mol;
1.5mol C2H5OH中含有氧原子的物质的量为1.5mol,含有氧元素的质量为:16g/mol×1.5mol=×24g,
故答案为:69g;9;24.
点评 本题考查了物质的量的计算,题目难度不大,注意掌握物质的量与摩尔质量之间的关系,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
1.国际无机化学命名委员会在1989年做出决定,建议把长式元素周期表原先的各族族号取消,由左至右改为18列.如碱金属元素为第1例,稀有气体元素为第18列.据此规定,下列说法错误的是( )
| A. | 第1列和第17列元素的单质熔沸点变化趋势相反 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第15列元素的最高价氧化物为R2O58 | |
| D. | 尚未发现的第113号元素在第七周期第13列 |
18.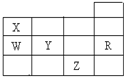 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | 元素原子半径:W<Y | |
| B. | X、Y的阴离子电子层结构都与R原子相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | 常温常压下五种元素的单质中,Z单质的沸点最高 |
5.已知aAn+与bBm-具有相同的电子层结构.以下关于A、B元素性质的说法中,一定正确的有①原子半径:A<B ②原子序数:a=b+m+n ③原子最外层电子数:B>A④离子半径:aAn+<bBm- ⑤原子的失电子能力:A>B( )
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
15.盐酸与块状CaCO3反应时,不能使反应的最初速率明显加快的是( )
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
2.一定温度下,向某密闭容器中加入0.2mol CO和0.2mol H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),4min时反应达到平衡状态,测得n(CO):n(CO2)=3:2,下列说法正确的是( )
| A. | 缩小容器的体积,混合气体的密度不变 | |
| B. | v(CO)=v(CO2)时,表明反应达到平衡状态 | |
| C. | 平衡时CO和H2O的转化率相等 | |
| D. | 无法计算该条件下反应的化学平衡常数 |
19.下列关于实验的说法正确的是( )
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| C. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 | |
| D. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 |
20.普通锌锰电池是我国最早进入市场的实用电池,筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2、碳黑等.在探究废干电池内的固体时,进行如图所示四步操作实验:
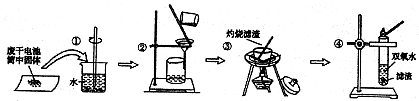
下列有关这些操作的叙述中,不正确的是( )

下列有关这些操作的叙述中,不正确的是( )
| A. | 操作①中玻璃棒的作用是加快固体溶解速度 | |
| B. | 取操作2的溶液于试管中,滴加适量氢氧化钠稀溶液,并用湿润的红色石蕊试纸放于试管口,发现试纸变蓝,可以证明有NH4Cl的存在 | |
| C. | 操作③中盛放药品的仪器是坩埚 | |
| D. | 操作④的目的是检验MnO2的存在 |

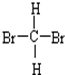 和
和