题目内容
20.请将正确答案填写在横线上(1)有下边各组物质,请按要求填入序号:
A.O2和O3(臭氧)
B.${\;}_{6}^{12}$C和${\;}_{6}^{13}$C
C.CH3-CH2-CH2-CH3和

D.
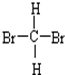 和
和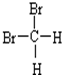
E.甲烷和乙烯
①B组二者互为同位素.
②A组二者互为同素异形体.
③C组二者互为同分异构体.
④D组中的二者是同一物质.
(2)某化学反应,设反应物总能量为E1,生成物总能量为E2.若E1>E2,则该反应为放热反应,反应物断键吸收的能量小于生成物成键释放的能量,△H<0.
(3)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)不能(B)能.
②如果(A或B)不能,说明其原因A不是氧化还原反应,没有发生电子的转移.
分析 (1)分子式相同,结构不同的化合物互称同分异构体;
质子数相同,中子数不同的同一元素的不同原子互称同位素,同位素必须原子;
同一元素形成的不同单质称同素异形体,同素异形体必须是单质;
(2)当反应物的总能量大于生成物的总能量时,反应放热;若形成新化学键释放的能量大于破坏旧化学键所吸收的能量,反应放热;
(3)①原电池反应是自发进行的放热的氧化还原反应,结合元素的化合价变化分析;
②原电池反应是自发进行的放热的氧化还原反应.
解答 解:(1)A.O2和O3(臭氧)是氧元素的不同单质,所以是同素异形体;
B.${\;}_{6}^{12}$C和${\;}_{6}^{13}$C都是碳元素的不同原子,所以是同位素;
C.CH3-CH2-CH2-CH3和  分子式相同,但结构不同,所以是同分异构体;
分子式相同,但结构不同,所以是同分异构体;
D.二溴甲烷在四面体结构,所以二溴甲烷只有一种,故 和
和 是同一物质;
是同一物质;
E.甲烷和乙烯分子式不同,结构不同,两者没有关系;
故答案为:①B,②A,③C,④D.
(2)某化学反应,设反应物总能量为E1,生成物总能量为E2.若E1>E2,则该反应为放热反应,反应物断键吸收的能量小于生成物成键释放的能量,△H<0;
故答案为:放;小于;<;
(3)①原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,(B)中Fe元素化合价发生变化,所以可以设计成原电池,
故答案为:不能;能;
②A不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,
故答案为:A不是氧化还原反应,没有发生电子的转移.
点评 本题考查了“四同”、化学变化中能量变化、原电池设计等,侧重考查学生知识运用能力,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
8.下列溶液氯离子的物质的量浓度与50mL 1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A. | 50 mL 3mol•L-1氯酸钠溶液 | B. | 75 mL 2mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3mol•L-1氯化钾溶液 | D. | 25 mL 3mol•L-1氯化镁溶液 |
15.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 乙酸 | C. | 乙醇 | D. | 甲烷 |
5.下列各种冶炼方法中,可制得相应金属的为( )
| A. | 加热氢氧化铝 | B. | 加热碳酸钙 | C. | 电解饱和食盐水 | D. | 电解熔融氯化镁 |
12.下列元素最高价氧化物的水化物溶于水一定是强碱溶液的是( )
| A. | 原子最外层只有1个电子的元素 | |
| B. | 原子次外层电子数是最外层电子数8倍的元素 | |
| C. | 原子次外层电子数是最外层电子数4倍的元素 | |
| D. | 原子的电子层数与最外层电子数相等的元素 |
9.下列反应中属于吸热反应的是( )
| A. | 铁跟盐酸反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 盐酸与氢氧化钠溶液反应 | |
| D. | 酒精燃烧 |