题目内容
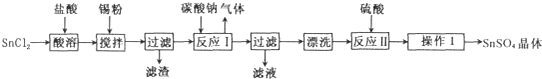
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 、 、过滤、洗涤、干燥.对沉淀进行洗涤的方法是 .
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因: .
(3)加入Sn粉的作用有两个:①调节溶液pH;② .
(4)酸性条件下,SnS04还可以用作双氧水去除剂,发生反应的离子方程式是: .
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/L K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr207溶液m mL.则锡粉中锡的质量分数是 .(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)

查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:
(3)加入Sn粉的作用有两个:①调节溶液pH;②
(4)酸性条件下,SnS04还可以用作双氧水去除剂,发生反应的离子方程式是:
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/L K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr207溶液m mL.则锡粉中锡的质量分数是
考点:制备实验方案的设计
专题:实验设计题
分析:(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶、过滤、洗涤得到;根据沉淀的洗涤方法来洗涤沉淀;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(5)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~
K2Cr2O7,据此计算.
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(5)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~
| 1 |
| 3 |
解答:
解:(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,沉淀的洗涤方法:将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2-3次;
故答案为:蒸发浓缩、冷却结晶;将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2-3次;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(5)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~
K2Cr2O7
Mg
mol
a×x bmol/L×
L
解得x=
.
故答案为:
.
故答案为:蒸发浓缩、冷却结晶;将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2-3次;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(5)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~
| 1 |
| 3 |
Mg
| 1 |
| 3 |
a×x bmol/L×
| m |
| 1000 |
解得x=
| 3mbM |
| 1000a |
故答案为:
| 3mbM |
| 1000a |
点评:本题以SnSO4制备为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写、滴定应用及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.

练习册系列答案
相关题目
下列说法正确的是( )
| A、向2.0mL浓度均为0.lmol/L的KCl、KI混合溶液中滴加l~2滴0.01mol/LAgNO3溶液.振荡,沉淀呈黄色,说明AgCl的溶解度比AgI的溶解度小 |
| B、分别在Na2CO3和NaHCO3两种物质的溶液中,加入少量澄清石灰水,能用来鉴别这两种白色固体 |
| C、向0.1mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D、向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )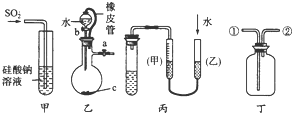

| A、甲装置:可用来证明硫的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法能检查此装置的气密性 |
| D、丁装置:可在瓶中先装入某种液体收集NO气体 |
下列实验操作中,不正确的是( )
| A、蒸馏操作时,应使温度计水银球的上端与蒸馏烧瓶的支管口下端相平 |
| B、用玻璃棒蘸取Na2CO3溶液,滴在干燥的pH试纸上,测定该溶液的pH |
| C、用纯碱溶液洗涤黏附在试管壁上的油 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2的体积为5.6L |
| B、标准状况下,22.4LCCl4所含的分子数为NA |
| C、标准状况下,1.8gH2 O中含有电子数为NA |
| D、常温常压下,10g氖气含有的原子数为NA |
毕昇得了感冒,校医室的刘大夫给他打了青霉素,青霉素的俗名是( )
| A、头孢 | B、水杨酸 |
| C、阿司匹林 | D、盘尼西林 |
下列说法中不正确的是( )
| A、食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| B、乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别 |
| C、乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同 |
| D、生活中食用的食醋、植物油、动物蛋白等都是混合物 |
下列溶液呈酸性的是( )
| A、NaHCO3溶液 |
| B、NaHSO4溶液 |
| C、Na2CO3溶液 |
| D、氨水与盐酸混合后c(NH4+)>c(Cl-)的溶液 |
下列关于电解质的说法正确的是( )
| A、NaOH溶液能导电,所以NaOH溶液为电解质 |
| B、氯化钠晶体不能导电,所以氯化钠为非电解质 |
| C、虽然液态氯化氢不导电,但氯化氢属于电解质 |
| D、液态的铜导电性很好,所以铜是电解质 |