题目内容
8.恒温下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )| A. | 保持容器体积不变,充入1molSO3(g) | |
| B. | 保持容器内压强不变,充入1molSO3(g) | |
| C. | 保持容器体积不变,充入1molO2(g) | |
| D. | 保持容器内压强不变,充入1molAr(g) |
分析 达到平衡后,改变条件,SO3的平衡浓度不改变的,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析.
解答 解:A、温度和容器的体积不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,不满足2molSO2,1molO2,与原来的平衡不是等效平衡,所以SO3气体平衡浓度改变,故A不符合;
B、温度和容器的压强不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,满足n(SO2):n(O2)=2:1,与原来的平衡是等效平衡,所以SO3气体平衡浓度不改变,故B符合;
C、保持温度和容器的体积不变,再充入1molO2(g),增大反应物的浓度平衡正移,平衡向正反应移动,SO3的平衡浓度增大,故C不符合;
D、保持温度和容器的压强不变,充入1mol Ar,体积增大,反应混合物产生的压强减小,平衡向正反应移动,移动的结果是增大SO3的浓度,但不能完全抵消因为体积增大引起的浓度减小,所以最终是SO3的平衡浓度减小,故D不符合;
故选:B.
点评 本题考查平衡移动、等效平衡等,难度中等,注意掌握等效平衡规律.

练习册系列答案
相关题目
19.已知Ksp(AgCl)=1.8×10-10 mol2•L-2,Ksp(AgI)=1.0×10-16 mol2•L-2.下列关于难溶物之间转化的说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低 $\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
16.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 17g NH4+中含有的质子数为11NA | |
| C. | 46 g NO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
3.在测定中和反应的反应热的实验中不需要用到的仪器是( )
| A. | 量筒 | B. | 温度计 | C. | 环形玻璃搅拌棒 | D. | 天平 |
13.下列各种试纸,使用时预先不能用蒸馏水湿润的是( )
| A. | 红色石蕊试纸 | B. | 淀粉KI试纸 | C. | pH试纸 | D. | 蓝色石蕊试纸 |
20.已知溴酸银的溶解是吸热过程,在不同温度下溴酸银溶解平衡曲线如图所示,下列说法正确的是( )
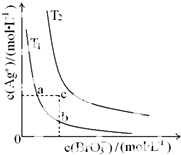

| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA | |
| B. | 标准状况下,22.4 L O2 作氧化剂时转移电子数一定为4NA | |
| C. | 10 L 0.1 mol/L 的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2 g丙烯中所含碳氢键数目为0.6 NA |
18.常温下某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-20,该溶液可能是( )
| A. | pH等于4的NH4Cl溶液 | B. | pH等于4的H2SO4溶液 | ||
| C. | pH等于10的Na2CO3溶液 | D. | 一定浓度的NaCl溶液 |