题目内容
18.常温下某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-20,该溶液可能是( )| A. | pH等于4的NH4Cl溶液 | B. | pH等于4的H2SO4溶液 | ||
| C. | pH等于10的Na2CO3溶液 | D. | 一定浓度的NaCl溶液 |
分析 水电离出的c(H+)和c(OH-)的乘积是1×10-20,由于c(H+)和c(OH-)的乘积小于10-14,说明水的电离受到了抑制,其溶质只能是酸或碱,据此进行判断.
解答 解:A、氯化铵是强酸弱碱盐,其水解能够促进水的电离,常温下由水电离出的c(H+)与c(OH-)的乘积为10-8,故A错误;
B、常温下pH=4的硫酸中,c(OH-)=1×10-10mol/L,水电离出来的氢离子浓度与氢氧根离子浓度相同,故B正确;
C、碳酸钠是弱酸强碱盐,其水解能够促进水的电离,由水电离出的c(H+)与c(OH-)的乘积为10-8,故C错误;
D、氯化钠溶液中由水电离出的c(H+)与c(OH-)的乘积为10-14,故D错误;
故选B.
点评 本题考查了水的电离、水的离子积常数,题目难度中等,注意水电离的氢离子与溶液酸碱性的关系.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.恒温下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
| A. | 保持容器体积不变,充入1molSO3(g) | |
| B. | 保持容器内压强不变,充入1molSO3(g) | |
| C. | 保持容器体积不变,充入1molO2(g) | |
| D. | 保持容器内压强不变,充入1molAr(g) |
9.维生素C是一种水溶性维生素(其水溶液呈酸性),结构如图所示.下列关于维生素C的叙述错误的是( )


| A. | 维生素C能使溴水褪色 | B. | 维生素C不能与碘单质反应 | ||
| C. | 维生素C可发生水解反应 | D. | 维生素C是较强的还原剂 |
6.一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III:
在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,
在III中充入2mol CO 和2mol H2O,
700℃条件下开始反应,达到平衡时,下列说法正确的是( )
在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,
在III中充入2mol CO 和2mol H2O,
700℃条件下开始反应,达到平衡时,下列说法正确的是( )
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I、III中反应的平衡常数相同 | |
| C. | 容器I中CO 的物质的量比容器II中的少 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和小于1 |
3.NO和CO都是汽车尾气里的有毒气体,它们能缓慢地反应生成N2和CO2,对此反应下列说法不正确的是( )
| A. | 降低压强能加快反应速率 | B. | 使用适当的催化剂能加快反应速率 | ||
| C. | 改变压强对反应速率无影响 | D. | 温度能加快反应速率 |
7.下列叙述中正确的是( )
| A. | 氧化剂中的每一种元素在反应中都得到电子 | |
| B. | 还原剂在同一反应中既可以是反应物,也可以是生成物 | |
| C. | 失电子多的还原剂,还原性不一定强 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
8.下列说法不正确的是( )
| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸(  )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用 和HCHO 为原料合成 和HCHO 为原料合成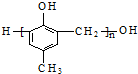 |
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):