题目内容
已知将盐酸逐滴加入Na2CO3中,发生的反应依次为:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑;现将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A、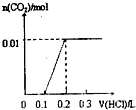 |
B、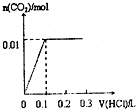 |
C、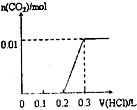 |
D、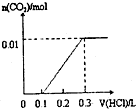 |
考点:离子方程式的有关计算
专题:图示题
分析:将0.4g即0.01molNaOH和1.06g即0.01mol Na2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸,盐酸先与NaOH反应,此时要消耗0.01molHCl,然后HCl+Na2CO3=NaHCO3+NaCl,又需要消耗HCl0.01mol,都没有二氧化碳气体产生,此时用去的盐酸的休积为
=0.2L,然后再用去0.01molHCl产生二氧化碳的物质的量为0.01mol,据此判断.
| 0.02mol |
| 0.1mol?L-1 |
解答:
解:将0.4g即0.01molNaOH和1.06g即0.01mol Na2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸,盐先与NaOH反应,此时要消耗0.01molHCl,然后HCl+Na2CO3=NaHCO3+NaCl,又需要消耗HCl0.01mol,都没有二氧化碳气体产生,此时用去的盐酸的休积为
=0.2L,然后再用去0.01molHCl产生二氧化碳的物质的量为0.01mol,根据图中横坐标用去盐酸的体积可知,C正确;
故选C.
| 0.02mol |
| 0.1mol?L-1 |
故选C.
点评:本题主要考查了化学计算,难度不大,解题时注意利用题中信息,明确反应的顺序是解题的关键.

练习册系列答案
相关题目
已知三种一元弱酸的电离常数大小如下:Ka(HX)>Ka(HY)>Ka(HZ);常温下pH相等的下列三种溶液:NaX、NaY、NaZ,其物质的量浓度从大到小的顺序正确的是( )
| A、c(NaX)>c(NaY)>c(NaZ) |
| B、c(NaZ)>c(NaY)>c(NaZ) |
| C、c(NaX)>c(NaZ)>c(NaY) |
| D、c(NaZ)>c(NaX)>c(NaY) |
有下列4种燃料电池的工作原理示意图,其中正极反应的产物为水的是( )
A、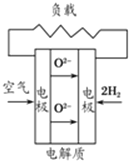 固化氧化物燃料电池 |
B、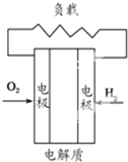 碱性氢氧燃料电池 |
C、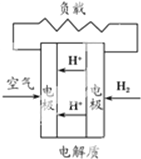 质子交换膜燃料电池 |
D、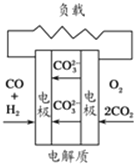 熔融盐燃料电池 |
下列说法正确的是( )
| A、硫酸和磷酸的摩尔质量相等 |
| B、摩尔质量越大,物质的质量越大 |
| C、HNO3的摩尔质量是63g |
| D、摩尔质量就等于该物质的相对分子质量 |
1mol12C的质量是( )
| A、0.012 g |
| B、12 kg |
| C、12 g |
| D、6.02×1023g |
下列各项叙述正确的是( )
| A、1.8 mol H2O的质量是1.8 g |
| B、H2SO4的摩尔质量是98 g |
| C、1 mol氯的质量是35.5 g |
| D、相同物质的量的氢气和氯气所含的分子个数相等 |
下列物质的名称和主要成分的化学式一致的是 ( )
| A、大理石、石灰石、生石灰、CaCO3 |
| B、烧碱、纯碱、火碱、NaOH |
| C、熟石灰、消石灰、石灰乳、Ca(OH)2 |
| D、苏打、小苏打、纯碱、Na2CO3 |
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||||
B、参加反应的被还原的氯气为
| ||||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||||
D、改变温度,产物中KClO3的最大理论产量为
|