题目内容
在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2.下列叙述中,错误的是( )
| A、化学反应速率:乙>甲 |
| B、平衡后N2的浓度:乙>甲 |
| C、H2的转化率:乙>甲 |
| D、平衡混合气中H2的体积分数:乙>甲 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,加入氮气和氢气发生的反应为:N2+3H2=2NH3,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,氢气转化率增大;
解答:
解:在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,加入氮气和氢气发生的反应为:N2+3H2=2NH3,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,氢气转化率增大;
A、乙容器中压强大于甲,反应速率快,故A正确;
B、甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2,平衡后氮气浓度乙大于甲,故B正确;
C、乙容器中压强大于甲,反应速率快,氢气转化率增大,故C正确;
D、乙容器中压强大于甲,反应速率快,氢气转化率增大,平衡混合气中H2的体积分数:甲>乙,故D错误;
故选D.
A、乙容器中压强大于甲,反应速率快,故A正确;
B、甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2,平衡后氮气浓度乙大于甲,故B正确;
C、乙容器中压强大于甲,反应速率快,氢气转化率增大,故C正确;
D、乙容器中压强大于甲,反应速率快,氢气转化率增大,平衡混合气中H2的体积分数:甲>乙,故D错误;
故选D.
点评:本题考查了化学平衡影响因素分析判断,注意恒温容器中平衡的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )
图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )| A、P1>P2 |
| B、m+n=2 |
| C、m+n=3 |
| D、P1、P2下平衡常数相同 |
苯和甲苯相比较,下列叙述中不正确的是( )
| A、都属于芳香烃 |
| B、都能在空气中燃烧 |
| C、都能使KMnO4酸性溶液褪色 |
| D、都能发生取代反应 |
已知N≡N键的键能是a kJ?mol-1,H-H键的键能是b kJ?mol-1,N-H键的键能是c kJ?mol-1,则N2(g)+3H2(g)?2NH3(g)的△H(kJ?mol-1)为( )
| A、3c-a-b |
| B、a+b-3c |
| C、a+3b-2c |
| D、a+3b-6c |
分别向下列物质的溶液中加入少量的Na2O2固体,不会出现浑浊的是( )
| A、CuCl2溶液 |
| B、FeCl3溶液 |
| C、饱和Ca(OH)2溶液 |
| D、NaHCO3溶液 |
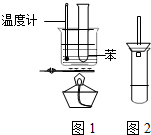 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去) )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.


