题目内容
14. 下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | C | CO | CO2 | O2 |
| B | Ca(OH)2 | CaCO3 | Ca(HCO3)2 | CO2 |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
分析 A、C和O2反应生成CO,CO和O2反应生成CO2,C和CO2反应可以生成CO;
B、Ca(OH)2和CO2反应生成CaCO3,CaCO3和CO2、H2O反应生成Ca(HCO3)2,Ca(OH)2 和Ca(HCO3)2反应生成CaCO3;
C、Al和NaOH反应生成AlO2-,不能一步生成Al(OH)3;
D、Cl2和Fe反应生成FeCl3,FeCl3溶液和Fe反应生成FeCl2,FeCl2和Cl2反应生成FeCl3.
解答 解:A、C和O2反应生成CO,CO和O2反应生成CO2,C和CO2反应可以生成CO,2C+O2=2CO,2CO+O2=2CO2,C+CO2=2CO,通过一步反应能实现,故A不符合;
B、Ca(OH)2和CO2反应生成CaCO3,Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3和CO2、H2O反应生成Ca(HCO3)2,CaCO3+CO2+H2O=Ca(HCO3)2,Ca(OH)2 和Ca(HCO3)2反应生成CaCO3,Ca(OH)2+Ca(HCO3)2=CaCO3↓+2H2O,通过一步反应能实现,故B不符合;
C、Al和NaOH反应生成AlO2-,不能一步生成Al(OH)3,故C符合;
D、Cl2和Fe反应生成FeCl3,3Cl2+2Fe=2FeCl3,FeCl3溶液和Fe反应生成FeCl2,2FeCl3+Fe=3FeCl2,FeCl2和Cl2反应生成FeCl3,2FeCl2+Cl2=2FeCl3,通过一步反应能实现,故D不符合;
故选C.
点评 本题考查了物质间的转化,明确物质的性质是解本题关键,注意反应物相同,反应条件不同、反应物的量不同、反应物的浓度不同,产物可能不同,为易错点,注意铁在氯气中燃烧,无论铁是否过量都生成氯化铁,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
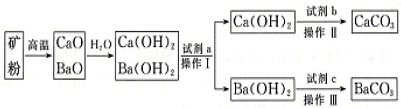
(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
| A. | 20克 | B. | 40克 | C. | 48克 | D. | 36克 |
| A. | 常温常压下,48gO2和O3含有的氧原子数均为3NA5.4g铝与足量NaOH反应转移的电子数为0.3NA | |
| B. | 12g重水(D2O)中含有的电子数为6 NA | |
| C. | 标准状况下,11.2L苯所含原子数为6NA | |
| D. | 160g胆矾溶于水形成1L溶液,溶液的物质的量浓度为1mol/L |
| A. |  用图装置除去Cl2中混有的少量HCl | |
| B. |  用图装置分离水和溴苯的混合物 | |
| C. |  用图装置制备并收集NO气体 | |
| D. |  用图装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
| A. | Ca(OH)2═Ca2++2OH- | B. | 酒精:CH3CH2OH═CH3CH2O-+H+ | ||
| C. | BaCl2═Ba2++Cl${\;}_{2}^{2-}$ | D. | H2SO4$\frac{\underline{\;通电\;}}{\;}$2H++SO${\;}_{4}^{2-}$ |
| A. | 反应总体向左进行 | |
| B. | 反应达到平衡时,H2的物质的量分数<50% | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应达到平衡时,H2的转化率为75% |
| A. | 可以用四氯化碳把溴水中的溴萃取出来,静置分层后,上层呈橙红色 | |
| B. | 可以用酒精萃取碘水中的碘 | |
| C. | 可以用水做萃取剂把碘从四氯化碳溶液中分离出来 | |
| D. | 萃取之后一般通过分液的方法将互不相溶的液体分离 |