题目内容
5.现有CaCO3、BaCO3的混合矿石粉末,为了制得纯净的CaCO3和纯净BaCO3,从有关资料中查得有关溶解度数据和工艺流程如下:| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
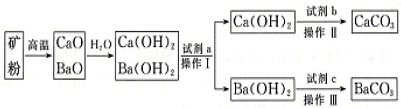
(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
分析 利用CaCO3、BaCO3的混合矿石粉末,制得纯净的CaCO3和纯净BaCO3,由分离流程及溶解度表可知,高温分解后,与水反应生成两种碱,因碱的溶解度受温度影响不同,则加水溶解,升高温度80℃,析出Ca(OH)2,操作I为过滤;然后向氢氧化钡溶液在中通入适量的二氧化碳、过滤得到BaCO3,而Ca(OH)2固体与碳酸钠溶液可反应生成CaCO3,以此来解答.
解答 解:由分离流程及溶解度表可知,高温分解后,与水反应生成两种碱,因碱的溶解度受温度影响不同,则加水溶解,升高温度80℃,析出Ca(OH)2,操作I为过滤;然后向氢氧化钡溶液在中通入适量的二氧化碳、过滤得到BaCO3,而Ca(OH)2固体与碳酸钠溶液可反应生成CaCO3,
(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料,
故答案为:利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料;
(2)由上述分析可知试剂a是水,操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液,
故答案为:水;将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液;
(3)由上述分析可知,试剂b与试剂c为不同物质,加入试剂c(CO2)后发生反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O,
故答案为:否;CO2+Ba2++2OH-=BaCO3↓+H2O.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离方法及溶解度应用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 5.6g铁与足量氯气反应,转移的电子数目为0.3NA | |
| C. | 常温常压下,NA个CO2和CO分子占有的体积约为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
| A. | 0.45g | B. | 0.54g | C. | 0.5g | D. | 0.35g |
| A. | Na+与Cl-之间的离子键 | B. | 水分子间的氢键 | ||
| C. | 水分子内的共价键 | D. | 上述所有作用力 |
| A. | 向氨水中加水可使溶液中n(H+)和n(OH-)均增大 | |
| B. | 若Na2A、Na2B溶液的pH分别为8和9,则酸性一定是H2A>H2B | |
| C. | 已知室温时,0.1mol•1-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.1% | |
| D. | 新制氯水中:c(H+)>c(Cl-)>c(CLO-)>c(OH-) |

(1)制备氯气选用的药品为:漂白精固体和浓盐酸,漂白精的有效成分是Ca(ClO)2,它与浓盐酸在常温下即可反应;相关的化学反应方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,如果C发生堵塞了,则B中的现象:B中长颈漏斗内液面上升,形成一段水柱,锥形瓶内液面下降.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O=SO42-+2Cl-+3H+或4HSO3-+Cl2=SO42-+2Cl-+3SO2↑+2H2O,判断改用NaHSO3溶液是否可行否(填“是”或“否”).
 下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | C | CO | CO2 | O2 |
| B | Ca(OH)2 | CaCO3 | Ca(HCO3)2 | CO2 |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯的结构简式C2H4 | B. | 乙醇的分子式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 高锰酸钾的分子式K2MnO4 |


 ;反应过程中只会释放出一种小分子CH4.
;反应过程中只会释放出一种小分子CH4.