题目内容
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1L0.2mol/L的氨水中含有0.2NA个N原子 | |
| B. | 标准状况下,2.24NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 含有10.7gFe(OH)3的胶体中,胶粒总数为0.1NA | |
| D. | 2.3gNa被O2完全氧化时,失去电子数为0.2NA |
分析 A.结合氮元素守恒分析判断;
B.2.24L NH3和CH4的混合气体,标准状况下都是0.1mol,总共含有1mol电子;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中胶粒的数目;
D.1molNa变成Na+时,失去的电子数为NA;
解答 解:A.1L0.2mol/L的氨水中溶质物质的量=1L×0.2mol/L=0.2mol,含有0.2NA个N原子,故A正确;
B.标准状况下,2.24L NH3和CH4的混合气体的物质的量是0.1mol,含有1mol电子,所含电子总数为NA,故B错误;
C.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中含有的胶粒数目,故C错误;
D.2.3g即0.1molNa变成Na+时,失去的电子数为0.1NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意氢氧化铁胶粒为氢氧化铁的聚集体,题目难度中等.

练习册系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 三氧化硫溶于水:SO3+H2O=SO42-+2H+ | |
| B. | 氯气溶于水:Cl2+H2O=2H++ClO-+Cl- | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 大理石与稀盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
2.常温下,在水中加入(或通入)少量下列物质,水电离的c(H+)•c(OH-)会增大的是( )
| A. | HCl | B. | NaCl | C. | Na2CO3 | D. | Na2O2 |
9.对已经达到衡的下列反应;2X(g)+Y(g)?2Z(g)减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆速率都增大,平衡向正反应方向移动 |
2.已知1mol白磷完全转化为红磷放出29.2kJ热量,下列两个反应:P4(白,s)+5O2(g)═2P2O5(s)△H=-Q1,4P(红,s)+5O2(g)═2P2O5(s)△H=-Q2,Q1与Q2的关系是( )
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法确定 |
9.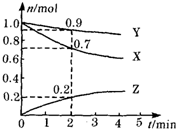 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )| A. | X+3Y=2Z 0.1mol•min-1 | B. | 2X+Y?2Z 0.1mol•min-1 | ||
| C. | X+2Y=Z 0.05mol•min-1 | D. | 3X+Y?2Z 0.05mol•min-1 |
6.下列排列的顺序正确的是( )
| A. | 热稳定性:H2O>HF>H2S | |
| B. | 熔点:Al>K>Na | |
| C. | 碱性:Al(OH)3>Mg(OH)2>LiOH | |
| D. | 结合质子能力:CO32->CH3COO->SO42- |
7.下列物质中所含分子物质的量最多的是( )
| A. | 88g CO2 | B. | 3 mol H2 | ||
| C. | 128 g SO2 | D. | 6.02×1023个硫酸分子 |